主な相違点 – 酸 vs 塩基
酸と塩基は化学で非常によく使われる用語で、化合物の化学的挙動によって2つの大きなセットを区別するために使用されます。
一般に、化学化合物は溶解度によって、酸、塩基、塩の3種類に分類されます。
酸はプロトン供与体として働く化合物で、放出可能なH+イオンを持っていることから容易に見分けることができる。
塩基はプロトンの受容体として働く化合物で、ほとんどの場合、放出可能なOH-イオンを持っているため、容易に認識することができる(無機塩基)。
酸と塩基の主な違いは、酸がプロトン供与体として働くのに対し、塩基はプロトン受容体として働くことで、酸はプロトン供与体、塩基はプロトン受容体として働く。
溶液中で酸と塩基が反応すると、H+イオンがOH-イオンによって中和され、一緒に水分子を形成する。
そして、そのイオン性のものが集まって塩を形成する。
酸とは
化学の理論では、酸はさまざまに定義される。
アレニウスの定義によれば、酸とは水に溶かしたときにH+イオンの濃度を増加させる物質です。
ブレンステッド=ローリーの定義によれば、酸はプロトン供与体として働くことができる物質です。
従って、脱プロトン化が容易で迅速な化合物ほど、その酸性度は強くなる。
ルイスの定義によると、酸は一対の電子を受け取ることができる物質です。
この場合、すべての金属カチオンと電子不足の分子は酸として働くことができる。
酸が一対の電子を受け入れやすいほど、そのルイス酸度は高くなる。
一般に、酸はpH7未満で存在し、強酸はpH値が低い。
酸は塩基と反応して塩を形成する。
酸は、青いリトマス紙を赤に変えることができます。
また、酸っぱい味もします。
(ただし、強酸を味わうのは得策ではありません)。
酸の代表的な例としては、塩酸(HCl)、硫酸(H2SO4)、酢酸(CH3COOH)などがあります。
ベースとは
塩基は、上記の定義を利用して、異なる観点からも定義することができる。
したがって、アレニウス塩基とは、水に溶かしたときにOH-イオンの濃度を増加させる物質です。
ブレンステッド-ロウリー塩基は、プロトン受容体として働くことができる物質です。
したがって、プロトンを受け入れやすい化合物ほどブレンステッド-ローリー塩基性が高い。
ルイスの定義によれば、塩基は一対の電子を受け入れることができる物質です。
そして、塩基が一対の電子を受け入れやすいほど、そのルイス塩基度は強くなる。
一般に、塩基はpH7以上に存在し、強塩基は高いpH値を持つ。
酸と反応して塩を形成する。
赤のリトマス紙を青に変えることができる。
また、少し石鹸のような味もします(ただし、強塩基の味を確かめることはお勧めできません)。
塩基の代表的な例としては、水酸化ナトリウム(NaOH)、水酸化カルシウム(Ca(OH)2)、NH3などです。
 水酸化ナトリウムペレットのサンプル
水酸化ナトリウムペレットのサンプル
酸と塩基の違い
定義
酸はプロトン供与体/電子対受容体であり、水溶液中のH+イオン濃度を増加させることができる。
塩基は、水溶液中のOH-イオン濃度を増加させることができるプロトン受容体/電子対受容体/です。
pH値
酸はpH値<7です。
塩基はpH値>7です。
リトマス試験紙の色彩変化
酸は、青いリトマス紙を赤に変えます。
塩基は赤のリトマス紙を青に変える。
塩の形成
酸は塩基と反応して、水性媒体中で塩を形成する。
塩基は水性媒体中で酸と反応し、塩を形成する。
テイスト
酸の味は酸っぱい
Bases taste soapy.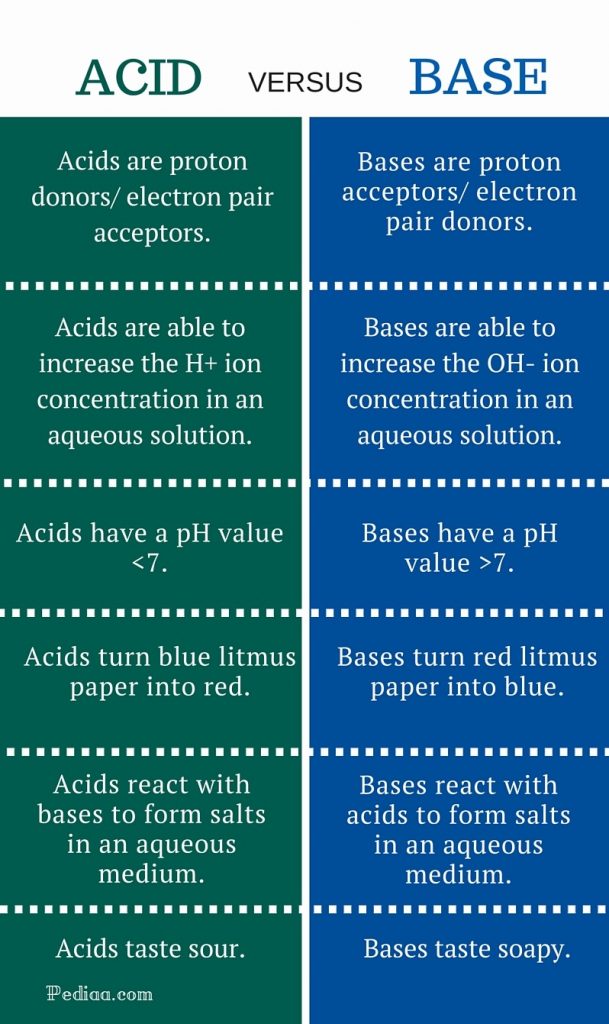
“Sulphuric acid on a piece of towel” by Toxic Walker – Own work. (CC BY-SA 3.0) via Commons
“SodiumHydroxide” by Walkerma – Own work. (パブリックドメイン) via Commons
保存する
