主な違い – グルコン酸カリウムと塩化カリウムの違い
カリウムは、”K “の文字で示される化学元素です。
電気分解によって初めて単離された金属です。
カリウムは非常に反応性が高く、様々な非金属原子と反応して異なる化合物を形成することができます。
グルコン酸カリウムと塩化カリウムは、そんなカリウムの化合物です。
グルコン酸カリウムは、重要なカリウムのサプリメントです。
グルコン酸カリウムと塩化カリウムの主な違いは、グルコン酸カリウムがグルコン酸の共役塩基のカリウム塩であるのに対し、塩化カリウムはカリウムのハロゲン化金属であることです。
グルコン酸カリウムとは?
グルコン酸カリウムは、グルコン酸の共役塩基のカリウム塩です。
D-グルコン酸カリウム塩、D-グルコン酸カリウムとも呼ばれます。
グルコン酸カリウムは、重量比16.69%のカリウムで構成されています。
グルコン酸はカルボン酸であるため、水酸基の酸素原子に水素原子と入れ替わりにK+1イオンが結合しています。
この化合物は固相で存在する。
グルコン酸カリウムの融点は約175oCです。
グルコン酸カリウムは無臭の化合物で、白色から黄色がかった結晶性の粉末または顆粒として入手できます。
わずかに塩味のある味です。
水に溶けやすく、空気中では安定です。
グルコン酸カリウムの保存温度は室温です。
この化合物の分子式は、C6H11KO7 です。
グルコン酸カリウムの IUPAC 名はカリウム (2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhe.Potassium です。
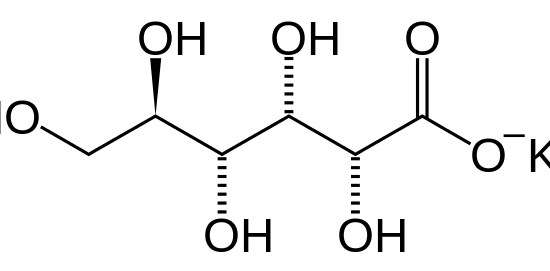 :図1 グルコン酸カリウムの化学構造
:図1 グルコン酸カリウムの化学構造
グルコン酸カリウムは、ミネラル補給や封鎖剤として使用される。
カプセルやバルクパウダーとして販売されている。
この化合物では、カリウムイオン(K+1)がグルコン酸の共役塩基にイオン結合で結合している。
つまり、K+1とグルコン酸アニオンの間には静電的な引力が存在する。
塩化カリウムとは?
塩化カリウムは、化学式KClで表されるハロゲン化金属の一種です。
無臭で白色の結晶性の粉末です。
水に溶けやすく、塩のような味がする。
肥料、火薬、科学的応用、食品加工など、多くの用途があります。
KClは、カリなどの鉱物から製造される。
KClのモル質量は74.548g/molです。
塩化カリウムの溶液は強い塩味を持っています。
塩化カリウムの融点は770oCで、沸点は1420oCです。
2732oCで塩化カリウムの結晶は昇華する。
したがって、昇華温度です。
昇華とは、固体が液相を経由せずに気相になることである。
図2: KClの格子構造図
KClはイオン性化合物です。
小さなカリウム陽イオンと大きな塩化物陰イオンからなる。
KClの結晶構造は、NaClと似ている。
それは、面心立方ユニットセルを有する。
KClの結晶は3方向に容易に劈開する。
グルコン酸カリウムと塩化カリウムの類似点
- どちらもカリウムの陽イオンを含む化合物です。
- 両方とも水に容易に溶ける。
- 両方の化合物の溶液は、塩味を持っています。
グルコン酸カリウムと塩化カリウムの違いについて
定義
グルコン酸カリウム。
グルコン酸カリウムは、グルコン酸の共役塩基のカリウム塩です。
塩化カリウム 塩化カリウムは、化学式KClで表されるハロゲン化金属です。
化学式
グルコン酸カリウム グルコン酸カリウムの化学式は、C6H11KO7です。
塩化カリウム。
塩化カリウムの化学式は、KClです。
モル質量
グルコン酸カリウム グルコン酸カリウムのモル質量は234.246g/molです。
塩化カリウム。
塩化カリウムのモル質量は74.548g/molです。
融点・沸点
グルコン酸カリウム グルコン酸カリウムの融点は、約175℃です。
塩化カリウム: 塩化カリウムの融点は770℃、沸点は1420℃です。
2732℃で塩化カリウムの結晶は昇華する。
テイスト
グルコン酸カリウム。
グルコン酸カリウムの溶液は、わずかに塩味を有する。
塩化カリウム: 塩化カリウムの溶液は、強い塩味を有する。
昇華
グルコン酸カリウム グルコン酸カリウムは昇華しない。
塩化カリウム: 塩化カリウムは昇華することができる。
結論
カリウムは反応性の高い化学元素であり、多くの化合物を形成することができる。
グルコン酸カリウムと塩化カリウムは、そのような化合物です。
グルコン酸カリウムと塩化カリウムの主な違いは、グルコン酸カリウムがグルコン酸の共役塩基のカリウム塩であるのに対し、塩化カリウムはカリウムの金属ハロゲン化物である点です。
