主な相違点 – シス型とトランス型の異性体
立体異性体とは、原子の接続性が同じである分子の空間配置の違いのことである。
これらの分子は化学式や分子式は同じだが、幾何学的な形状が異なる。
これらの立体異性体は、これらの分子間の類似性を考慮すると、いくつかのカテゴリーに分類することができる。
シス-トランス異性体は、アルカン、より具体的にはアルケンに見られる異性体の一種である。
シス-トランス異性体は、側鎖の位置が変わるだけで、他の部分は同じ分子である場合に見出される。
シス異性体とトランス異性体の主な違いは、シス異性体が本質的に極性であるのに対し、トランス異性体は比較的非極性であることです。
シス異性体とは
シス異性体とは、原子の接続性が同じで、同じ側に見られる側鎖で構成されている分子のことです。
例えば、アルケンでは、炭素-炭素二重結合が少なくとも1つ存在する。
2つの炭素原子に結合している同一の基が、分子の同じ側に存在する場合、シス異性体と呼ばれます。
シス異性体であるためには、分子は2つの同一の側基と2つの異なる側基を持つ必要がある。
2つの同じ側基は、2つのビニル炭素原子(二重結合になっている炭素原子)に結合している必要がある。
上の図に示すように、2-ブテンはシス-トランス異性体です。
ここで、シス異性体は、ビニル炭素原子1個に2個のメチル基が結合したものです。
この2つのメチル基は、分子の同じ側にある。
同じ側にある同一の基は、その分子の極性に影響を与える。
もし同じ側にもっと電気陰性な側鎖基があったら、その分子には非常に高い極性が存在することになる。
したがって、その分子は高極性分子になる。
この極性の増加により、これらの分子間には強い引力が働く。
この結果、強い引力が分子同士が離れるのを抑えるため、沸点が高くなる。
しかし、シス異性体は分子間の反発力により密にならないため、融点は比較的低くなる。
トランス異性体とは
トランス異性体とは、原子の接続が同じで、同一の側鎖が反対側にある分子のことです。
ここでは、同一の側鎖は十字に配置されている。
トランス異性体であるためには、2つの同一の側基と2つの異なる側基を持つ必要がある。
この場合、2つの同一の側鎖は2つのビニル炭素原子に結合しているが、これらの基は反対方向に位置している。
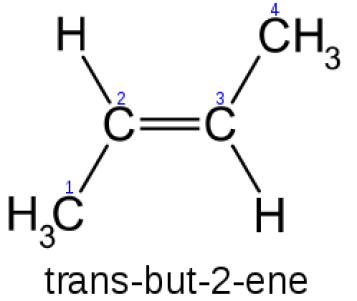 :図2 2-ブテンのトランス異性体
:図2 2-ブテンのトランス異性体
上の図に示すように、トランス異性体は2つのメチル基が反対側にある。
2つのメチル基は、同じ炭素原子に結合していない。
したがって、これはトランス異性体の良い例と言えます。
トランス異性体は多くの場合、非極性分子です。
しかし、存在する側鎖の種類によってある程度の極性がある場合もあります。
しかし、極性が少ない/ないため、トランス分子間には強い引力は存在しない。
そのため、トランス型異性体の沸点は比較的低い。
シス型とトランス型の異性体の違い
定義
シス異性体。
シス異性体とは、原子の接続が同じで、同じ側に見られる側鎖基で構成されている分子のこと。
トランス異性体。
トランス異性体:原子の接続が同じで、反対側にある同一の側鎖で構成される分子。
極性
シス異性体。
シス異性体は常に極性分子です。
トランス異性体。
トランス異性体は、極性が低いか非極性です。
融点
シス異性体。
シス異性体の融点は、分子のパッキングが緩いため、比較的低い。
トランス異性体。
トランス異性体の融点は、分子が密に詰まっているため比較的高い。
沸点
シス異性体。
シス異性体の沸点は、強い引力が存在するため、比較的高い。
トランス異性体。
強い引力がないため、沸点は比較的低い。
結論
シス-トランス異性体は、原子の接続性は同じであるが、性質が異なる分子間の違いを説明するものです。
これらの異なる特性は、2つの分子の空間的な配置の違いによって引き起こされる。
シス異性体とトランス異性体の主な違いは、シス異性体が本質的に極性であるのに対し、トランス異性体は比較的非極性であるということである。
