主な違い – アルファヘリックスとベータプリーツシート
アルファヘリックスとベータプリーツシートは、タンパク質の2次構造の違いです。
アルファヘリックスとは、ポリペプチド鎖が右巻きまたはらせん状に巻かれた構造です。
アルファヘリックスでは、すべてのバックボーンN-H基が、4残基前に配置されたバックボーンC=O基と水素結合をする。
ここで、水素結合はらせん構造を作るためにポリペプチド鎖の中に現れる。
ベータシートは、ベータ鎖が少なくとも2〜3個の骨格水素結合によって横方向につながったもので、一般にねじれたプリーツ状のシートを形成している。
アルファヘリックスとは対照的に、ベータシートの水素結合は、あるストランドのバックボーンのN-H基と、隣接するストランドのバックボーンのC=O基の間で形成される。
これがαヘリックスとβプリーツシートの主な違いです。
アルファヘリックスとは
タンパク質はポリペプチド鎖から構成されており、ポリペプチド鎖の折り畳み形状によって、一次、二次、三次、四次と分類される。
ポリペプチド鎖の二次構造としてよく見られるのは、α-ヘリックスとβ-プリーツシートです。
タンパク質のα-ヘリカル構造は、その骨格であるアミド基とカルボニル基の間の水素結合により形成される。
これは右巻きで、ポリペプチド鎖中に通常4〜40個のアミノ酸残基が含まれている。
下図はαヘリックスの構造を示している。
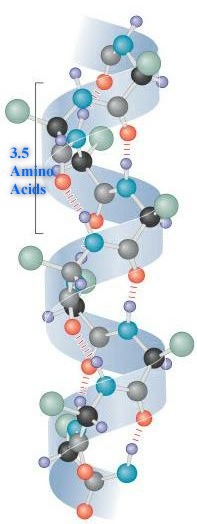
あるアミノ酸残基のN-H基と、4残基前に配置された別のアミノ酸のC=O基の間で水素結合が形成される。
この水素結合がαらせん構造を作るのに重要であり、らせんの1ターンには3.6残基のアミノ酸が存在する。
R基が大きすぎるアミノ酸(トリプトファン、チロシンなど)、小さすぎるアミノ酸(グリシンなど)はαヘリックスを不安定にさせる。
プロリンもまた、その不規則な形状のためにα-ヘリックスを不安定にする。
そのR-グループはアミド基の窒素に結合し、立体障害を引き起こすのです。
さらに、プロリンの窒素には水素が存在しないため、水素結合に参加することができない。
それとは別に、α-ヘリックスの安定性は、水素結合に関与するC=O基の個々の双極子によって引き起こされる、ヘリックス全体の双極子モーメントに依存する。
安定なα-ヘリックスは、双極子モーメントを中和するために、通常、荷電したアミノ酸で末端が覆われる。
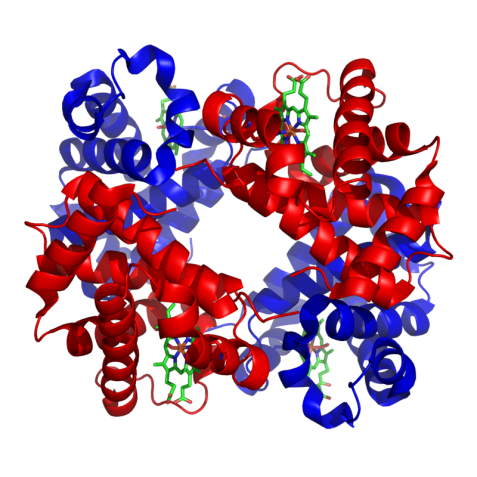 A ヘモグロビン分子。
A ヘモグロビン分子。
4つのヘム結合サブユニットを持ち、それぞれの大部分がα-ヘリックスでできている。
#ベータプリーツシートとは
ベータプリーツシートは、タンパク質の二次構造の一種である。
ベータシートは、少なくとも2〜3個の骨格水素結合で横方向につながったベータ鎖からなり、一般にねじれたプリーツ状のシートを形成している。
一般に、1本のβ鎖は3〜10個のアミノ酸残基を含み、これらのβ鎖は広範な水素結合ネットワークを形成しながら他のβ鎖と隣接して配置されている。
ここで、ある鎖の骨格にあるN-H基は、隣接する鎖の骨格にあるC=O基と水素結合を形成している。
ペプチド鎖の2つの末端をN-末端とC-末端に割り当てて、その方向を説明することができる。
N末端はペプチド鎖の一端を表し、遊離のアミン基が存在する。
同様に、C末端はペプチド鎖のもう一方の末端を表し、ここではフリーのカルボキシル基が利用可能である。
隣接するβ鎖は、反平行、平行、または混合配置で水素結合を形成することができる。
反平行配列では、あるスタンドのN-末端は次のスタンドのC-末端に隣接している。
平行配列では、隣接する鎖のN-末端は同じ方向に向いている。
下図は、平行配列と反平行配列のβ鎖の構造と水素結合のパターンを示している。
#αヘリックスとβプリーツシートの違い
形状
αヘリックス:αヘリックスは右巻きコイル状の棒状構造です。
ベータプリーツシート。
ベータシートはシート状の構造体。
フォーメーション
アルファヘリックス:ポリペプチド鎖の中で水素結合を形成し、らせん構造を形成する。
ベータプリーツシート 2本以上のβ鎖がH結合で結ばれ、βシートが形成される。
ボンド
すなわち、あるアミノ酸残基のN-H基と、4残基前に配置された別のアミノ酸のC=O基との間で水素結合が形成される。
ベータプリーツシート。
隣接するペプチド鎖のN-H基とC=O基の間に水素結合が形成される。
-R グループ
アルファヘリックス:アミノ酸の-R基がヘリックスの外側に配向している。
ベータプリーツシート。
-R基がシートの内側と外側の両方に向いている。
番号
αヘリックス:1本鎖でもよい。
ベータプリーツシート。
ベータ鎖は1本では存在できず、2本以上でなければならない。
タイプ
αヘリックス:1種類のみ。
ベータプリーツシート。
平行、反平行、混合があります。
品質
アルファヘリックス:100o回転、1回転あたり3.6残基、1つのアルファ炭素から2番目の炭素まで1.5Ao上昇
ベータプリーツシート。
アミノ酸
アルファヘリックス:アルファヘリックスはアミノ酸の側鎖を好み、ヘリックスのコアにあるバックボーンのH-結合をカバーし保護することができる。
ベータプリーツシート。
伸長した構造は、アミノ酸の側鎖のために最大限の空間を空ける。
そのため、大きな嵩高い側鎖を持つアミノ酸はベータシート構造を好む。
優先順位
Alpha Helix: Ala, Leu, Met, Phe, Glu, Gln, His, Lys, Argのアミノ酸を好みます。
Beta Pleated Sheet: Beta sheet prefers Tyr, Trp, (Phe, Met), Ile, Val, Thr, Cys.
“アルファヘリックスタンパク質構造” [Public Domain] via Commons Wikimedia
“Hempglobin molecule” By Zephyris at the English language Wikipedia (CC BY-SA 3.0) via Commons Wikimedia
“パレルレルとアンチパレル” by Fvasconcellos – 自作.Created by uploader upon request by Opabinia regalis., (Public Domain) via Commons Wikimedia
保存する
