分子間力とは、隣接する分子間に働く相互作用力のことである。
分子間力には、強いイオン-双極子相互作用、双極子-双極子相互作用、ロンドン分散相互作用、誘導双極子結合などいくつかの種類が存在する。
これらの分子間力のうち、ロンドン分散力と双極子-双極子力はファンデルワールス力に分類される。
この記事では、次のようなことを見ている。
- 双極子-双極子相互作用とは何か
- ロンドン分散力とは
- ファンデルワールス力はどのように分子を結合させるか
双極子-双極子相互作用とは?
電気陰性度の異なる2つの原子が一対の電子を共有するとき、電気陰性度の高い原子が一対の電子を自分の方に引き寄せます。
そのため、わずかに負(δ-)になり、電気陰性度の低い原子にわずかに正(δ+)の電荷が発生する。
このようなことが起こるには、2つの原子の電気陰性度の差が0.4以上である必要があります。
以下に典型的な例を示す。
図1: 双極子-双極子相互作用の例
ClはHよりも電気陰性度が高い(電気陰性度の差は1.5)。
そのため、一対の電子はよりClに偏り、δ-となる。
このδ-端が他の分子のδ+端を引き寄せ、両者の間に静電結合が形成される。
このような結合を双極子-双極子結合といいます。
このような結合は、分子の周りに非対称な電気雲が存在する結果です。
水素結合は双極子-双極子結合の特殊な種類です。
水素結合が起こるためには、水素原子に電気陰性度の高い原子が結合している必要がある。
そうすると、共有された一対の電子は、より電気陰性度の高い原子の方に引っ張られます。
また、電気陰性度の高い原子が隣接しており、その原子に一対の電子が乗っている必要があります。
これを水素受容体と呼び、水素供与体から電子を受け取ります。
 図2: 水素結合
図2: 水素結合
上の例では、水分子の酸素原子が水素供与体として振る舞います。
アンモニア分子の窒素原子は、水素受容体として振る舞う。
水分子の酸素原子は、アンモニア分子に水素を供与し、双極子結合を作る。
このような結合を水素結合と呼びます。
ロンドン分散相互作用とは
ロンドン分散力は、主に無極性分子に作用する。
これは、分子を形成する原子の電気陰性度がほぼ同じであることを意味する。
したがって、原子に電荷が形成されることはない。
ロンドン分散の理由は、分子内の電子のランダムな移動にある。
電子はいつでも分子のどの端にも存在し、その端はδ-となる。
そのため、分子のもう一方の端はδ+になる。
このように、ある分子に双極子が現れると、別の分子にも双極子を誘起することができる。
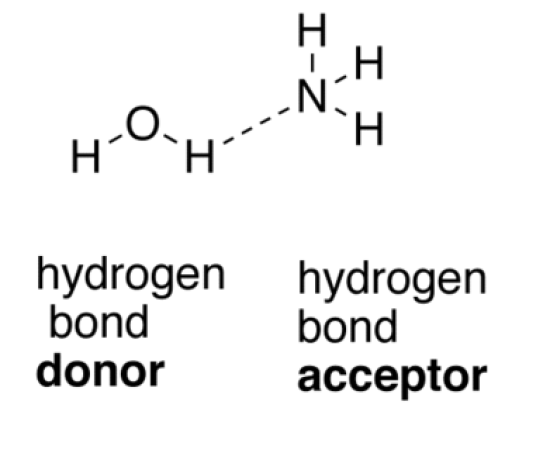 図3: ロンドン分散力の例
図3: ロンドン分散力の例
上の図では、左側の分子δ-が近傍の分子の電子を反発させ、その端にわずかな陽性を誘起していることがわかる。
これにより、2つの分子の反対側に帯電した端の間に引力が発生する。
このような結合は、ロンドン分散結合と呼ばれる。
これらは最も弱い分子間相互作用と考えられており、一時的なものである可能性がある。
非極性分子が非極性溶媒に溶けるのは、ロンドン分散結合の存在によるものです。
ファンデルワールス力はどのように分子を結合させるのか?
上記のファンデルワールス力は、イオン力よりやや弱いと考えられています。
水素結合は、他のファンデルワールス力よりはるかに強いと考えられています。
ロンドン分散力は、最も弱いタイプのファンデルワールス力です。
ロンドン分散力は、ハロゲンや希ガスに多く存在する。
分子同士を結びつけている力が強くないので、分子は自由に浮遊している。
そのため、大きな体積を占める。
双極子-双極子相互作用はロンドン分散力より強く、液体に多く存在する。
双極子相互作用でまとまった分子を持つ物質を極性物質と呼ぶ。
極性物質は別の極性溶媒にのみ溶解することができる。
次の表は、2種類のファンデルワールス力を比較対照しています。
| 双極子-双極子相互作用(Dipole-Dipole interactions) | ロンドン分散力(London Dispersion forces) |
| 電気陰性度の差が大きい(0.4)原子を持つ分子間に形成される|ランダムに動く電子の非対称な分布により双極子が分子に誘起される。 | |
| 比較的強く、エネルギーも大きい。 | |
| 極性物質に存在し、非極性物質にも存在する。 | |
| 水、p-ニトロフェニル、エチルアルコール|ハロゲン(Cl2、F2)、希ガス(He、Ar)|など。 |
しかし、ファンデルワールス力は、イオン結合や共有結合に比べると弱い。
そのため、破壊するために多くのエネルギー供給は必要ない。
