ヘモグロビン(Hb)は、赤血球に含まれる金属タンパク質です。
赤血球は酸素を全身に運搬する。
魚類を除くすべての脊椎動物は、赤血球の中に酸素運搬体としてヘモグロビンを持っています。
ヘモグロビンは、赤血球の乾燥重量の96%を占め、鉄分を含んでいる。
人間の体にはすべてヘモグロビンが存在する。
正常な成人男性のヘモグロビン値は13.8~17.2g/dLです。
成人女性(非妊娠時)のヘモグロビン量は12.1~15.1g/dLが望ましいとされています。
この記事では、次のことを見ていきます。
- ヘモグロビンの構造について
- 人体におけるヘモグロビンの働きとは?
ヘモグロビンの構造について
ヘモグロビンは、4つのグロビン・サブユニットが四面体構造をとっている、多サブユニットの球状タンパク質です。
各球状タンパク質サブユニットにはタンパク質鎖があり、タンパク質以外の補酵素であるヘム基と結合している。
グロビン蛋白質のα-ヘリックス構造は、ヘム基を結合させるポケットを作る。
グロビンタンパク質は、細胞質でリボザイムによって合成される。
ヘム部分はミトコンドリア内で合成される。
帯電した鉄原子は、同一平面上にある4つの窒素原子と鉄の共有結合によってポルフィリン環に保持される。
これらの窒素原子は、4つのグロビンサブユニットのそれぞれのF8ヒスチジン残基のイミダゾール環に属している。
ヘモグロビンの中で、鉄はFe2+として存在する。
人体には3種類のヘモグロビンが存在する。
ヘモグロビンA、ヘモグロビンA2、ヘモグロビンFの3種類があり、ヘモグロビンAは最も一般的なタイプです。
ヘモグロビンAは、HBA1、HBA2、HBB遺伝子によってコードされている。
ヘモグロビンAの4つのサブユニットは、2つのαサブユニットと2つのβサブユニット(α2β2)で構成されている。
ヘモグロビンA2、ヘモグロビンFは稀で、それぞれαとδのサブユニット2個、αとγのサブユニット2個から構成されている。
乳児の場合、ヘモグロビンの型はHb F(α2γ2)です。
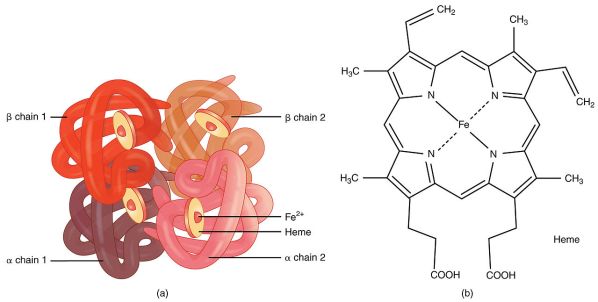 図1 ヘモグロビンの構造
図1 ヘモグロビンの構造
人体におけるヘモグロビンの働きとは?
- ヘモグロビンは酸素運搬体です。
- ヘモグロビンは、二酸化炭素を運ぶ。
- ヘモグロビンは血液に赤色を与える。
- ヘモグロビンは、赤血球の形を維持する。
- ヘモグロビンは、緩衝材の役割を果たす。
- ヘモグロビンは他のリガンドと相互作用する。
- ヘモグロビンの分解により、生理活性のある異種物質が蓄積される。
酸素キャリア
ヘモグロビンの主な働きは、肺から全身の組織へ酸素を運ぶことである。
ヘモグロビンの酸素結合容量は1gあたり1.34mL O2です。
ヘモグロビンの各グロビンサブ単位は、1個のFe2+イオンと結合することができる。
ヘモグロビンの酸素に対する親和性は、Fe2+イオンによって獲得される。
Fe2+は1個の酸素分子と結合することができる。
酸素が結合すると、Fe2+はFe3+に酸化される。
Fe2+と結合した酸素分子の1つの原子はスーパーオキシドになり、もう1つの酸素原子は斜めに突出した状態になる。
酸素と結合したヘモグロビンはオキシヘモグロビンと呼ばれる。
血液が酸素不足の組織に到達すると、酸素はヘモグロビンから解離し、組織内に拡散される。
酸素は、ATPを生成する酸化的リン酸化と呼ばれるプロセスにおいて、終末電子受容体として働く。
O2が除去されると、鉄は還元型に変化する。
酸素が結合していないヘモグロビンはデオキシヘモグロビンと呼ばれる。
Fe2+がFe3+に酸化されると、O2と結合できないメトヘモグロビンが生成される。
炭酸ガスキャリア
ヘモグロビンも組織から肺へ二酸化炭素を輸送する。
二酸化炭素の80%は血漿を経由して運ばれる。
二酸化炭素はヘモグロビンの酸素結合部位と競合することはない。
ヘモグロビンの酸素結合部位と競合せず、鉄結合部位以外のタンパク質構造に結合する。
炭酸ガスが結合したヘモグロビンはカルバミノヘモグロビンと呼ばれる。
赤血球への影響
ヘモグロビンは、Fe2+イオンによって赤血球に赤い色をつけます。
赤血球があると、血液は独特の赤い色になる。
赤血球のない血漿は、淡い黄色をしている。
赤血球の形は、ヘモグロビンによって保たれている。
赤血球は、中央が扁平にくぼんだ両凹型の円盤状をしている。
断面はダンベル状です。
ヘモグロビン遺伝子もまた、様々な対立遺伝子から構成されている。
ほとんどの突然変異体は病気を引き起こさない。
しかし、中にはヘモグロビン異常症のような遺伝性疾患を引き起こす変異体もあります。
 :図2 赤血球
:図2 赤血球
バッファリング動作
ヘモグロビンは血液のpHを7.4に保っている。
血液中に二酸化炭素が蓄積されると、pHは7.4から低下する。
このpHの変化は、換気によって元に戻すことができる。
ヘモグロビンのこの緩衝作用により、このpHを好む体内のすべての酵素反応は妨げられることなく行われる。
リガンドとの相互作用
ヘモグロビンは、一酸化炭素、酸化窒素、シアン、一酸化硫黄、硫化物、硫化水素など、他のリガンドとも結合する。
一酸化炭素との結合は不可逆的であるため、時に致死的となることがあります。
また、ヘモグロビンは薬物を作用部位まで運ぶことができる。
生理活性異化物の生成
老化や細胞の欠陥によって赤血球は死滅し、様々な生理活性のある異化物が蓄積される。
死んだ赤血球のヘモグロビンは、ヘモグロビントランスポーターであるCD163によって循環から排除される。
単球やマクロファージで起こるヘム分解は、一酸化炭素の自然発生源となる。
ビリルビンはヘム分解の最終産物です。
胆汁として腸内に分泌される。
ビリルビンはウロビリノーゲンに変換され、糞便中に含まれるため、独特の黄色を呈している。
一方、ヘムから取り除かれた鉄は、フェリチンに変換され、後に使用するために組織に貯蔵される。
ヘモグロビンは、赤血球以外の体内の細胞にも存在する。
ヘモグロビンを運ぶ細胞としては、マクロファージ、肺の肺胞細胞、腎臓のメサンギウム細胞などがあります。
ヘモグロビンは、これらの細胞で鉄代謝の調節や抗酸化物質として機能している。
2017. 2017年2月15日アクセス
2. Davis C. P. and Shiel W. C. “Hemoglobin”. メディシンネット、2015.htm。
