主な違い – 結合型分子軌道と反結合型分子軌道
分子軌道説は、分子内の原子間の化学結合を説明する理論です。
結合を形成するためには、2つの原子軌道が互いに重なり合うことが必要であるとしています。
この重なりによって、2つの軌道が混ざり合い、分子軌道が形成される。
分子軌道には、結合分子軌道と反結合分子軌道の2種類があります。
結合分子軌道は、結合電子で構成されている。
これらの電子は互いに対をなして共有結合を形成している。
反結合分子軌道は、結合に関与しないため、結合の外側に存在する。
結合分子軌道と反結合分子軌道の大きな違いは、結合分子軌道が分子の形を表すのに対し、反結合分子軌道は分子の形を決定するのに寄与しないことである。
結合分子軌道とは何か
結合分子軌道とは、化学結合の形成に関与する分子軌道の一種である。
この軌道は、2つの異なる原子の原子軌道が重なり合うことで形成される。
この重なりによって、2つの原子軌道が混ざり合い、分子軌道が形成される。
このように混ざり合うためには、2つの原子軌道が同等のエネルギーと正しい対称性を持っている必要がある。
結合分子軌道の電子密度は、反結合分子軌道のそれよりも高い。
この結合分子軌道のエネルギーは、結合分子軌道を形成するために混合された原子軌道のエネルギーよりも小さくなります。
この結合分子軌道は、エネルギー準位が低いほど安定性が高いことを示すため、より安定です。
また、結合分子軌道は、ある分子の分子形状の決定に寄与している。
結合電子対はこの結合分子軌道に存在するため、結合分子軌道の空間的な配置が分子の形状を表している。
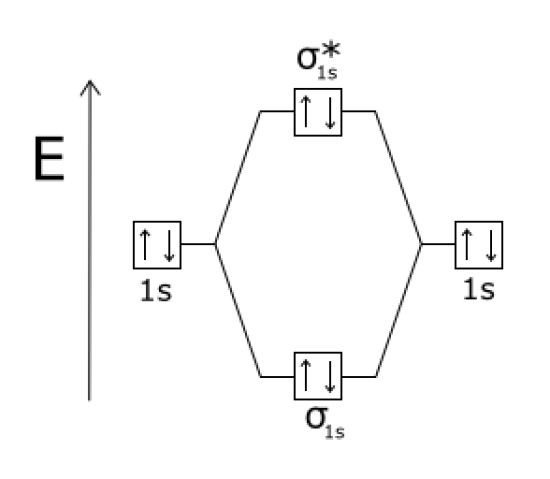
上の図は、He2分子の分子軌道図です。
左右に2個のH原子の原子軌道が示されている。
中央には、結合軌道と反結合軌道が示されている。
ここで、結合軌道はHの1s軌道の結合軌道であるため、σ1sと与えられている。
“E “はエネルギーを表している。
したがって、結合分子軌道のエネルギー準位は、反結合分子軌道や原子軌道のエネルギー準位よりも小さくなる。
反結合分子軌道とは何か
反結合分子軌道とは、2つの原子核の間の領域外にある電子を含む軌道のことである。
反結合軌道にある電子は、ほとんどの時間を原子核の外側で過ごすため、分子の安定性を低下させる。
そのため、結合分子軌道に比べて反結合分子軌道の電子密度は小さく、反結合分子軌道は結合の外側にある電子密度を示している。
反結合分子軌道は、原子軌道や結合分子軌道に比べて高いエネルギーを持っています。
これは、これらの軌道にある電子は、2つの原子核の反発を抑えることに貢献しないためです。
そのため、反結合分子軌道に電子を持つ化合物の安定性は低くなる。
しかし、安定な化合物では、反結合分子軌道に電子が存在しないか、あっても少ない。
反結合分子軌道の空間的な配置は、分子の形や幾何学的な形状を決定しない。
 :図2 He2分子の分子軌道エネルギー
:図2 He2分子の分子軌道エネルギー
上の図から、結合分子軌道の電子密度は、反結合分子軌道の電子密度と等しいことがわかる。
従って、非常に不安定な分子であることがわかる。
従って、He2分子は存在しない。
反結合分子軌道は、σ(*)で与えられる。
結合分子軌道と反結合分子軌道の違い
定義
結合分子軌道。
結合分子軌道とは、化学結合の形成に関与する分子軌道の一種である。
反結合分子軌道。
2つの原子核の間の領域外にある電子を含む軌道のこと。
電子密度
結合分子軌道。
結合分子軌道の電子密度が高い。
反結合分子軌道。
反結合分子軌道の電子密度は低い。
エネルギー
結合分子軌道。
結合分子軌道のエネルギーは比較的低い。
反結合分子軌道。
反結合分子軌道のエネルギーは比較的高い。
代表的なもの
結合分子軌道。
結合分子軌道:アスタリスクマーク(※)を付けずに表現しています。
反結合分子軌道。
反結合分子軌道:アスタリスクマーク(※)を用いて表現する。
分子の幾何学
結合分子軌道。
分子の形状は、結合分子軌道の空間的な配置で表される。
反結合分子軌道。
分子の形状は、反結合分子軌道の空間的配置には依存しない。
電子
結合分子軌道。
結合分子軌道にある電子は、結合の形成に寄与する。
反結合分子軌道。
反結合分子軌道の電子は、結合の形成に寄与しない。
安定性
結合分子軌道。
結合分子軌道の安定性は比較的高い。
反結合分子軌道。
反結合分子軌道の安定性は比較的低い。
結論
分子軌道説は、2つの原子間の化学結合が、原子軌道の重なりや混合によって形成されることを説明するものです。
この原子軌道の混合は、分子軌道と呼ばれる新しい軌道を形成する。
分子軌道は、結合分子軌道と反結合分子軌道の2種類に分けられる。
結合分子軌道と反結合分子軌道の主な違いは、結合分子軌道は分子の形状を表すのに対し、反結合分子軌道は分子の形状の決定には寄与しない点です。
