生きている細胞内の生化学反応は、酵素によって触媒される。
酵素は不活性型として合成され、その後、活性型に変換される。
酵素の活性は、一次構造のアミノ酸配列によって決定される。
酵素の活性部位に基質が結合することで、特定の化学反応が特異的に促進される。
酵素の活性部位は、基質結合部位と触媒部位で構成されている。
どの基質が酵素に結合できるかは、活性部位のアミノ酸残基が作り出す特異的な化学環境によって決定される。
本稿では、その解説を行う。
- 酵素とは何か、酵素はどのように働くのか
- 酵素の活性部位とは?
- 酵素と基質はどのように結合するか?
酵素とは何か、酵素の働きは?
酵素は、生物学的な触媒として働くことができるタンパク質分子です。
酵素が作用する分子は、基質と呼ばれます。
特定の基質に酵素が作用してできるさまざまな分子を生成物と呼びます。
酵素は、生化学反応の活性化エネルギーを低下させることにより、生化学反応を触媒する。
酵素による反応の触媒作用は、細胞内のその特定の反応の速度を増加させます。
酵素の中には、同じ反応を触媒することができるものがあります。
これらはアイソザイムと呼ばれる。
約3,000の酵素のユニークなセットは、遺伝子的に合成されるようにプログラムされており、細胞に個性を与えている。
タンパク質以外では、リボザイムなどのRNA分子も酵素として働くことができる。
もし、1つの酵素に欠陥があれば、その影響は甚大です。
酵素は3つの特徴を持っています。
第一に、酵素は反応速度を速める。
第二に、ある特定の酵素が、ある特定の基質に特異的に作用し、生成物を生み出す。
第三に、酵素は低活性から高活性へ、あるいはその逆へと制御することができる。
図1に、基質と酵素の結合、反応速度の増大による生成物の生成、生成物の放出について示す。
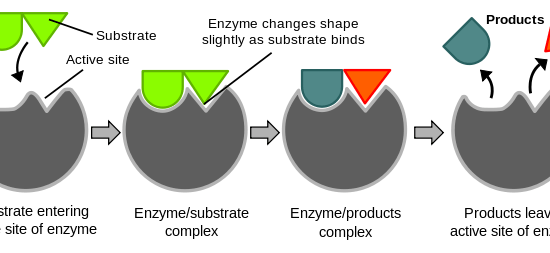 :図1 酵素の働き
:図1 酵素の働き
酵素の活性は、主にタンパク質鎖のアミノ酸配列に依存する。
酵素は一次構造と呼ばれるアミノ酸が一列に並んだ状態で合成される。
一次構造は、自発的に折り畳まれて、二次構造と呼ばれるαヘリックスやβシートからなる立体構造をとる。
酵素の二次構造は、再び折り畳まれて、三次構造と呼ばれるコンパクトな立体構造になる。
酵素の三次構造は、不活性型として存在する。
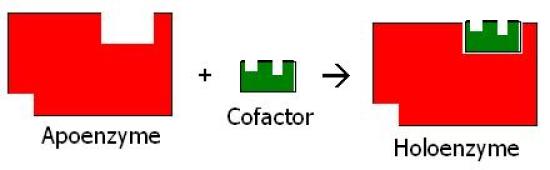
酵素複合体のポリペプチドまたはタンパク質の部分はアポ酵素と呼ばれる。
アポ酵素の合成当初の不活性型は、プロ酵素または酵素原と呼ばれる。
ポリペプチド部分をアポ酵素に変換するために、ザイモゲンからいくつかのアミノ酸が除去される。
多くの場合、アポ酵素は補酵素と呼ばれる他の化合物と結合し、反応を触媒する。
アポ酵素と補酵素の組み合わせはホロ酵素と呼ばれる。
アポ酵素と補酵素、そしてホロ酵素の関係を図2に示します。
図2:アポ酵素・補酵素・ホロ酵素の関係
酵素の活性部位とは?
酵素の活性部位とは、特定の基質が酵素に結合し、化学反応を触媒する部位のことである。
基質結合部位は、触媒部位とともに、酵素の活性部位を形成している。
酵素は、特定の基質と結合することで、基質を何らかの形で変化させる化学反応を触媒する。
基質は、その酵素よりも小さなサイズです。
基質は、活性部位によって酵素の内部に完全に配向している。
酵素の中には、1つ以上の基質結合部位が存在することがあります。
触媒部位は結合部位の隣に存在し、触媒作用を行う。
2~4個程度のアミノ酸で構成され、触媒作用に関与する。
活性部位を形成するアミノ酸は、酵素のアミノ酸配列の中で、それぞれ異なる場所に位置している。
そのため、酵素の一次構造が立体構造に折り畳まれて、活性部位が一体となる必要がある。
図3に、酵素であるリゾチームの活性部位を示す。
基質であるペプチドグリカンは黒色で示されている。
 :図3 酵素の活性部位
:図3 酵素の活性部位
酵素には、活性部位とは別に、エフェクター分子と結合し、酵素のコンフォメーションやダイナミクスを変化させるポケットが存在する。
このポケットはアロステリック部位と呼ばれ、酵素の反応速度のアロステリックな調節に関与している。
酵素と基質はどのように結合するのか?
酵素の結合部位は、基質と特異的に結合する。
この結合により、基質が触媒作用のために方向づけられる。
酵素の結合部位にあるアミノ酸残基は、弱酸性または塩基性、親水性または疎水性、正電荷、負電荷または中性であることがあります。
結合部位内に作られる非常に特異的な化学環境が、酵素の特異性を決定する。
活性部位と基質との間には、ファンデルワールス力、親水性/疎水性相互作用、水素結合などの一時的な共有結合が形成される。
酵素は基質とともに、酵素-基質複合体を形成する。
基質と酵素の結合には、ロックアンドキーモデルと誘導結合モデルの2つのメカニズムがあります。
ロックアンドキーモデルは、基質が酵素に瞬時にぴったりと結合することを主張する。
この結合により、酵素の構造はわずかに変化する。
ロックアンドキーモデルでは、正しいサイズと形状の基質のみが酵素と結合することができる。
誘導結合モデルでは、酵素の活性部位の形状は基質の結合に応じて連続的に変化します。
このことは、他の分子が酵素の活性部位に結合することを説明する。
しかし、このように基質と酵素がダイナミックに結合することで、基質が安定化し、生化学反応の速度が向上するのです。
ヘキソキナーゼは、基質であるアデニン三リン酸やキシロースの形にフィットして、その形を変える酵素です。
図4にヘキソキナーゼの誘導結合モデルを示す。
結合部位と基質は青色と黒色で示されている。
図4: ヘキソキナーゼの誘導結合モデル
酵素による化学反応の触媒作用は、化学反応の活性化エネルギーを低下させるいくつかの方法で起こる可能性がある。
まず、酵素は遷移状態に対して相補的な電荷分布を作ることで遷移状態を安定化させ、エネルギーを低下させる。
第二に、酵素は、元の遷移状態よりも低いエネルギーを持つ第二遷移状態を含む代替反応経路を促進する。
第三に、酵素は基質の基底状態を不安定化させる。
結論
酵素は、生きた細胞の中で生化学反応の速度を上げる化学反応です。
酵素の多くは、一次構造で合成されるタンパク質です。
このアミノ酸鎖が立体構造に折り畳まれることで、酵素の活性型が生成される。
この折りたたみにより、酵素の中に活性部位と呼ばれるポケットが作られる。
基質は酵素の活性部位に特異的に結合し、体内で起こる生化学反応の速度を増加させる。
N.p., n.d. Web. 2017年5月21日付。
