α-アミラーゼとα-グルコシダーゼの主な違いは、α-アミラーゼが食事の炭水化物を単糖に分解するのに対し、α-グルコシダーゼは単糖をさらに分解して吸収性のあるグルコースにする点です。
α-アミラーゼとα-グルコシダーゼは2種類の消化酵素で、食物の炭水化物をグルコースに消化することに関与している。
両酵素とも(1→4)-α-結合に作用する。
α-アミラーゼとは
α-アミラーゼは、デンプンなどの炭水化物をグルコースなどの単糖類に消化する消化酵素です。
通常、デンプンやグリコーゲンなどの大きなα結合を持つ多糖類のα結合を加水分解すると、デキストリンやマルトースなどが得られる。
一方、α-アミラーゼは、ヒトや哺乳類に存在するアミラーゼの主要な形態です。
また、α-アミラーゼは、食物予備軍であるデンプンを含む種子にも発生する。
さらに、菌類が腐敗した有機物中にもα-アミラーゼが分泌されている。
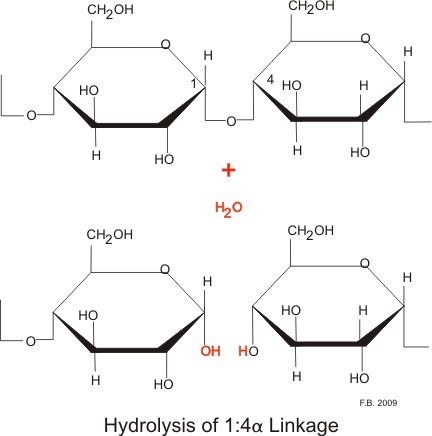 :図1 α-アミラーゼによる1-4結合の加水分解
:図1 α-アミラーゼによる1-4結合の加水分解
口の中以外では、α-アミラーゼは膵液中に多く存在する。
通常、唾液中のアミラーゼは食物中の大きな不溶性デンプンをアミロデキストリン、エリスロデキストリン、アクロデキストリンなどの水溶性デンプンに消化する。
しかし、これらの小さなデンプンは、さらに唾液中のα-アミラーゼによってマルトースに消化される。
唾液中のα-アミラーゼは、直鎖状のα(1,4)グリコシド結合に作用する。
また、唾液中のα-アミラーゼは胃のpHにより不活性化される。
膵臓のα-アミラーゼはアミロースのα(1-4)グリコシド結合をランダムに切断し、デキストリン、マルトース、マルトトリオースなどを生成する。
α-グルコシダーゼとは?
α-グルコシダーゼは、小腸の刷子縁に存在する酵素です。
また、α-グルコシダーゼは、末端が非還元性のα(1-4)グリコシド結合に作用する。
しかし、α-グルコシダーゼはα-グルコース1分子を遊離させる。
したがって、α-グルコシダーゼはデンプンや二糖類をグルコースに消化する。
一方、この酵素の起源は動物、植物、細菌、真菌のいずれでもよい。
植物では、この酵素は発芽した穀物および発芽していない穀物の細胞内コンパートメントに存在する。
また、植物の成熟期には、α-グルコシダーゼが植物多糖の組成を制御している。
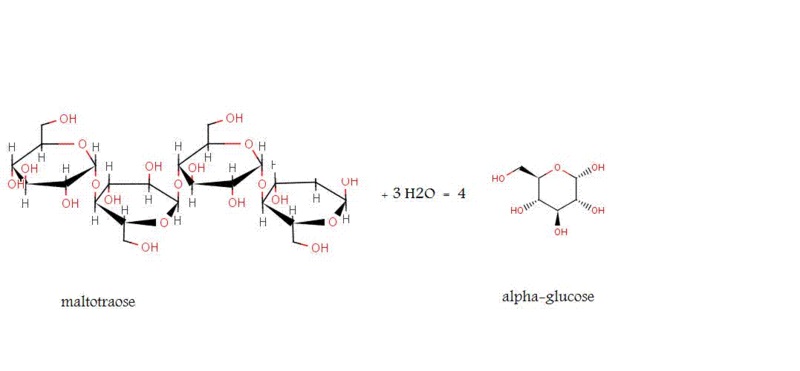 図2:α-グルコシダーゼの作用
図2:α-グルコシダーゼの作用
重要なことは、α-グルコシダーゼはヒトのいくつかの疾患と関連していることである。
それらは、グリコーゲン貯蔵病II型、糖尿病、無精子症、そして抗ウイルス剤です。
グリコーゲン貯蔵病II型では、α-グルコシダーゼ酵素の欠損による疾患です。
また、α-グルコシダーゼ阻害剤であるアカルボースは、腸内でα-グルコシダーゼという酵素を可逆的に阻害することができます。
この阻害作用は、糖質の消化の遅れによるグルコースの吸収を著しく低下させる。
したがって、アカルボースは、糖尿病の症状の発生を防ぐことができる。
一方、無精子症の診断は、精液中のα-グルコシダーゼ活性の測定によるものです。
それとは別に、α-グルコシダーゼの阻害は、HIVの融合やHBVの分泌を防ぐことができる。
α-アミラーゼとα-グルコシダーゼの類似性
- α-アミラーゼとα-グルコシダーゼは、肉食動物の消化器系に存在する2種類の消化酵素です。
- どちらの酵素も小腸に存在する。
- 両酵素とも(1→4)-α-結合に作用する。
#αアミラーゼとαグルコシダーゼの違い
定義
α-アミラーゼとは、デンプン分子を分解し、α-1,4グリコシド結合に作用して低分子デキストリンに加水分解する酵素を指し、α-グルコシダーゼとは、小腸のブラシボーダーに存在するグルコシダーゼで、α結合に作用して、還元結合していないα-D-グルコース残基を加水分解してD-グルコースを遊離させる酵素。
発生状況
α-アミラーゼは口腔内と小腸に、α-グルコシダーゼは小腸のブラシボーダーに存在する。
活動内容
α-アミラーゼは糖質を二糖類に分解し、α-グルコシダーゼは二糖類をグルコースに消化する。
結論
簡単に説明すると、α-アミラーゼとα-グルコシダーゼは2種類の糖質消化酵素です。
また、消化管の小腸で炭水化物を消化する。
通常、α-アミラーゼはデンプンなどの炭水化物をブドウ糖に消化し、α-グルコシダーゼは二糖類、つまりマルトースをブドウ糖に消化する。
したがって、α-アミラーゼとα-グルコシダーゼの主な違いは、炭水化物の消化の種類です。
