主な違い – 電離と解離
電離と解離は、ほぼ同じ意味を表す関連用語ですが、使われる場面は異なります。
イオン化は、異なる種類の分離を指すことがあります。
電子の除去による原子のイオン化であったり、液体溶液中でのイオンの生成であったりします。
一方、解離は、物質が原子、イオン、ラジカルなどの小さな構成要素に分離することを指します。
イオン化と解離の主な違いは、イオン化は常に電荷を帯びた粒子を形成するのに対し、解離は電荷を帯びた粒子を形成する場合としない場合があることです。
イオン化とは
イオン化とは、原子や分子がプラスまたはマイナスの電荷を持つようになる過程を指します。
これは、原子や分子から電子を得るか失うかによって起こり、その結果、イオンは陽イオンまたは陰イオンになります。
中性原子または分子から電子を失うと陽イオンになり、中性原子から電子を得ると陰イオンになり、負の電荷を帯びます。
原子のイオン化は、原子から電子が取り出されることによって起こります。
中性で気体の原子からエネルギーを加えて電子を取り除くと、1価の陽イオンが形成されます。
このときに必要なエネルギー量を、その原子の第一イオン化エネルギーといいます。
液体溶液中で起こるイオン化は、溶液中にイオンが形成されることです。
例えば、HCl分子を水に溶かすと、ヒドロニウムイオン(H3O+)が生成される。
ここで、HClは水分子と反応し、正電荷のヒドロニウムイオンと負電荷の塩化物(Cl-)イオンを生成する。
電離は、衝突によって起こることもあります。
これは主に気体に電流を流したときに起こる。
電流中の電子が気体分子から電子を取り除くのに必要な十分なエネルギーを持っていれば、気体分子から電子を強制的に取り除き、個々のプラスイオンとマイナス電子からなるイオンペアを生成する。
ここで、一部の電子は電子を引き抜くのではなく、気体分子に付着する傾向があるため、マイナスイオンも形成されることがあります。
電離は、放射線エネルギーや十分に高エネルギーの荷電粒子が固体、液体、気体に通過することで起こります。
例えば、アルファ粒子、ベータ粒子、ガンマ線は物質を電離させることができます。
解離とは
化学において、解離とは物質が原子、イオン、分子などの小さな粒子に分解されることです。
これらの小さな粒子は、通常、所定の条件下で再結合することができる。
解離は原子、イオン、ラジカルを形成することがあります。
解離の主な原因は、溶媒の添加と熱の形でのエネルギーの付加です。
イオン性化合物を水に溶かすと、そのイオン成分に解離する。
例えば、NaClを水に溶かすと、Na+カチオンとCl-アニオンが生成され、Na+カチオンとCl-アニオンを含む溶液ができる。
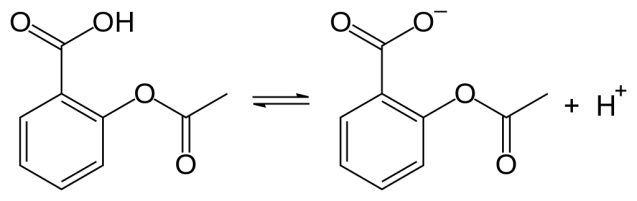 : 図2: アセチルサリチル酸の解離
: 図2: アセチルサリチル酸の解離
解離定数
解離定数とは、解離後の生成物濃度と反応物濃度の比のことである。
これは温度が一定であれば一定の値を持つ。
水を例にとって考えてみよう。
H2O H+ + OH-
すると、水の解離定数は
Kw = [H+][ OH-] / [H2O] となります。
電離と解離の違い
定義
電離。
イオン化とは、原子や分子がプラスまたはマイナスの電荷を持つようになることである。
解離。
解離とは、物質が原子、イオン、分子などのより小さな粒子に分解されること。
コンセプト
イオン化。
イオン化とは、イオンが生成されることである。
解離。
解離とは、より大きな化合物から小さな成分が形成されることである。
理論編
電離。
原子や分子が電子(または少数の電子)を得たり失ったりすることでイオン化が起こる。
解離。
溶媒を加えたり、熱というエネルギーを加えたりすることで解離が起こる。
エンドプロダクト
イオン化。
電離は必ず最終的にイオンを形成する。
解離。
解離は、出発物質より小さい原子、イオン、分子を形成する。
結論
電離と解離は、基本的に同じ理論、すなわち構成要素の分離を表している。
電離と解離の大きな違いは、電離は常に電荷を持った粒子を形成するのに対し、解離は電荷を持った粒子を形成するかしないかです。
