主な違い – 硫酸と亜硫酸の違い
硫黄は、化学記号「S」、原子番号16の化学元素です。
硫黄の電子配置は[Ne] 3s²3p⁴ です。
したがって、化学結合に参加できる一番外側の電子殻に6個の電子を有しています。
硫黄は最大6個の共有結合を作ることができます。
それは多種多様な化学化合物を形成します。
硫酸と亜硫酸はそのような化合物であり、酸です。
硫酸と亜硫酸の主な違いは、硫酸が化学式H2so4で表され、優れた酸化剤であるのに対し、亜硫酸は化学式H2SO3で表され、優れた還元剤であることです。
硫酸とは?
硫酸は、化学式H2SO4で表される酸です。
常温では無色無臭のシロップ状の液体です。
硫酸のモル質量は98.079g/molです。
強酸であり、腐食性があります。
したがって、この酸を取り扱う際には注意が必要である。
硫酸の融点は10oCで、沸点は337℃です。
硫酸の化学構造を考えると、硫黄原子は分子の真ん中にある。
硫黄原子には2つの-OH基が単共有結合で結合している。
酸素原子2個は二重結合で硫黄原子に結合している。
分子は四面体構造です。
硫酸分子には2つの-O-H結合があり、この結合は非常に極性が高い。
この極性により、H原子は容易に失われる。
硫酸のイオン化は2つのステップで行われます。
H2SO4(aq)+H2O(l) → HSO4-(aq) + H3O+(aq)
HSO4-(aq)+H2O(l) → SO4-2(aq) + H3O+(aq)となります。
硫酸は濃厚な状態では強い酸化剤です。
しかし、希釈すると酸化力が弱くなる。
例えば、高温では、濃硫酸はBr-をBr2に酸化することができます。
2HBr(aq) + H2SO4(aq) → Br2(aq)+SO2(aq) + 2 H2O(l)
硫酸の硫黄原子の酸化状態は+6であり、硫黄原子が保持できる最大の酸化状態です。
したがって、硫酸はより低い酸化状態に還元されることはあっても、還元剤として作用することはありません。
亜硫酸とは?
亜硫酸は、化学式 H2SO3 で表される酸です。
共有結合のみを含む共有化合物です。
亜硫酸のモル質量は82.07 g/molです。
亜硫酸は弱酸性で不安定です。
二酸化硫黄(SO2)を水に溶かすと生成されます。
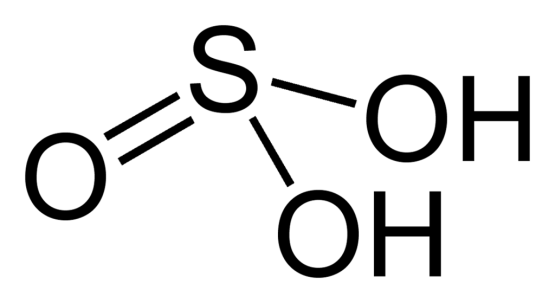 図2: 亜硫酸の化学構造
図2: 亜硫酸の化学構造
亜硫酸の化学形状は三角錐です。
電子の形状は四面体だが、孤立電子対が存在するため、分子の形状は三角錐です。
亜硫酸は水溶液中でのみ生成するため、純化合物として単離することはできない。
亜硫酸(水溶液)は還元剤です。
これは、この化合物中の硫黄原子が酸化状態+4であり、さらに酸化して硫黄の最高酸化状態である+6にすることができるからです。
また、亜硫酸は漂白剤としての働きもあります。
硫酸と亜硫酸の違い
定義
硫酸。
硫酸は、化学式H2SO4で表される酸です。
亜硫酸。
亜硫酸は、化学式H2SO3で表される酸。
モル質量
硫酸の場合 硫酸のモル質量は98.079g/molです。
亜硫酸。
亜硫酸のモル質量は82.07g/molです。
硫黄の酸化状態
硫酸のこと。
硫酸の硫黄原子の酸化状態は+6です。
亜硫酸。
亜硫酸の硫黄原子の酸化状態は+4です。
ジオメトリー
硫酸。
硫酸の分子は正四面体構造をしている。
亜硫酸 亜硫酸: 亜硫酸分子は三角錐の構造をしている。
自然
硫酸。
硫酸は良い酸化剤です。
亜硫酸(ありゅう) 亜硫酸は良い還元剤です。
結論
硫酸と亜硫酸は、S原子、H原子、O原子を含む酸性の共有結合化合物です。
硫酸と亜硫酸の主な違いは、硫酸が化学式h2so4であるのに対し、亜硫酸は化学式ah2so3であることである。
