グロビンとグロブリンの主な違いは、グロビンがヘム含有球状タンパク質のスーパーファミリーであるのに対し、グロブリンはより分子量の大きい球状タンパク質のファミリーである点です。
また、グロビンは水溶性であるのに対し、グロブリンは純水には溶けず、希薄な塩類溶液にのみ溶解する。
グロビンとグロブリンは、血漿中に溶けている2種類のタンパク質です。
グロビンとグロブリンは血漿中に存在する2種類のタンパク質で、その濃度は臓器別の病態を表している。
また、グロブリンには、α1グロブリン、α2グロブリン、βグロブリン、γグロブリンがあり、ミオグロビンとヘモグロビンが代表的なグロブリンです。
主な対象分野
- グロビンとは
– 定義、構造、機能 - グロブリンとは
– 定義、構造、機能 - グロビンとグロブリンの類似点とは
– 共通点の概要 - グロビンとグロブリンの違いについて
– 主な違いの比較
この記事の重要な単語
グロビンとは
グロビンは、ヘムを含む球状タンパク質のスーパーファミリーに属するタンパク質です。
そのため、グロビンの主な機能は、酸素を結合したり、運搬したりすることである。
体内には、ミオグロビンとヘモグロビンの2種類のグロビンが存在する。
ここで、ミオグロビンは、脊椎動物の筋肉組織で酸素を結合するタンパク質です。
一方、ヘモグロビンは、脊椎動物の赤血球に含まれる酸素運搬用の金属タンパク質です。
また、一部の無脊椎動物の組織にも存在する。
さらに、これらのタンパク質はいずれもヘム補欠基を持ち、酸素と可逆的に結合する。
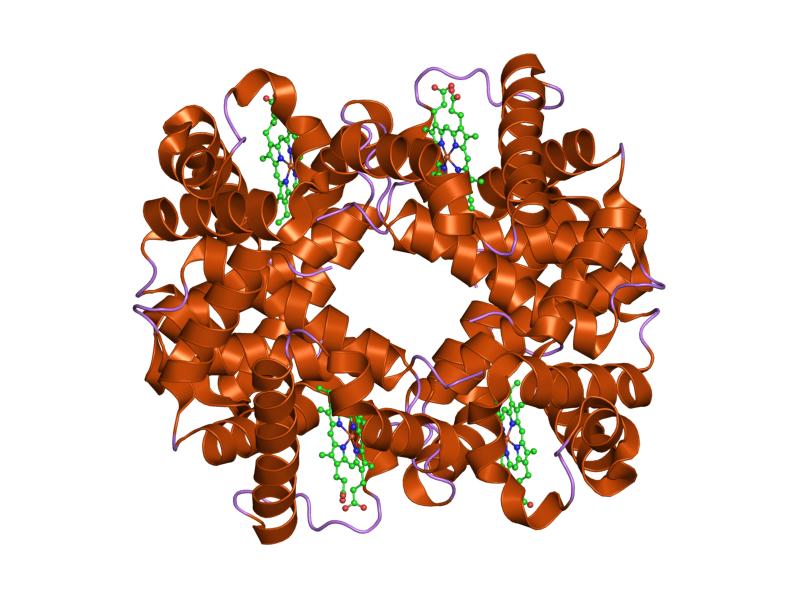 :図1 ヘモグロビン-α鎖
:図1 ヘモグロビン-α鎖
さらに、どの種類のグロビンも、8本のα-ヘリカルセグメントからなるグロビンフォールドが主な構造的特徴です。
また、これは3次元的な折り方です。
しかし、この8本のヘリは、コアに特定の非局所的な構造を共有している。
一般に、この特定の構造は、その一次構造だけでなく、空間的にも互いに近いアミノ酸を含んでいる。
しかも、その平均充填角は50度です。
一方、脊椎動物に存在する他の6種類のグロビンは、アンドログロビン、サイトグロビン、グロビンE、グロビンX、グロビンY、ニューログロビンです。
グロブリンとは
グロブリンは球状タンパク質の仲間で、アルブミンよりも分子量が大きい。
一般にアルブミンは球状タンパク質であるが、分子量が小さいためグロブリンではない。
しかし、グロブリンは分子量が大きいため、純水には溶けない。
しかし、希薄な塩分濃度には溶ける。
一方、肝臓や免疫系は、グロブリンを産生する。
さらに、グロブリンは、α1グロブリン、α2グロブリン、βグロブリン、γグロブリンの4種類に分類される。
ガンマグロブリンの一群は、免疫グロブリンまたは抗体として知られています。
なお、グロブリンの血清中の濃度は2.6〜3.5g/dLです。
図2:免疫グロブリン
また、αグロブリンは、グロブリンの中で最も分子量が小さい。
分子量は約93kDaです。
一方、γグロブリンは最も分子量が大きく、約1193kDaです。
さらに、マメ科植物に含まれるグロブリンは、ビクシリンとレグミンの2種類です。
さらに、その機能は貯蔵タンパク質としての役割を担っている。
グロビンとグロブリンの類似性
- グロビンとグロブリンは、血漿中に存在する2種類のタンパク質です。
- それぞれ異なる条件下で水に溶ける。
- また、血液中で重要な働きをしています。
グロビンとグロブリンの違い
定義
グロビンとは、酸素の結合と輸送を担うヘム含有球状タンパク質のスーパーファミリーを指し、グロブリンとは、塩溶液に溶ける単純タンパク質で、血液血清タンパク質の大部分を占めるファミリーを指します。
例
グロブリンには、ミオグロビンとヘモグロビンの2種類があり、α1グロブリン、α2グロブリン、βグロブリン、γグロブリンが主な種類です。
機能
グロブリンは、酸素の結合や運搬を主な役割とするが、肝臓や免疫系で作られる血清タンパク質です。
分子量
さらに、グロブリンの分子量が100-1000kDa程度であるのに対し、グロビンの分子量は16kDa程度です。
溶解度
さらに、グロビンは水溶性であるが、グロブリンは純水には溶けず、希薄な塩溶液にのみ溶ける。
結論
グロビンは、血液中の分子量の低いタンパク質群です。
しかも、ミオグロビンやヘモグロビンの構造成分です。
したがって、グロビンの主な働きは、酸素を結合して運搬することである。
これに対し、グロブリンは血液中の球状タンパク質の一種です。
ただし、アルブミンと比較すると分子量が大きい。
さらに、体内では免疫機能を有している。
したがって、グロビンとグロブリンの主な違いは、その分子量と機能です。
