Main Difference – Valency vs Oxidation State(価電子と酸化状態の違い
すべての化合物は、異なる元素の原子で構成されています。
これらの原子は、それぞれが持つ自由軌道の数、または特定の原子が放出できる電子の数によって、異なる比率で組み合わされます。
このような原子の組み合わせの違いを説明するために使われる用語が、価数と酸化状態です。
価数と酸化状態の主な違いは、価数は特定の元素の原子の最外殻に存在する電子の数であり、酸化状態は特定の化合物中の元素が失ったり得たりした電子の数であることです。
Valencyとは
原子価は、特定の元素の最外殻に存在する電子の数として定義することができます。
価数によって、特定の原子が持つことのできる結合の最大数が決まります。
周期表の元素は、原子が中性で気体の状態にあるときに持つことのできる価電子(最外殻にある電子)の数によってグループ分けされています。
次の表で説明します。
| — | — | — | — |
| 元素|原子番号|電子配置|価数||||||など
| ナトリウム(Na)|11|1s22s22p63s1|1|||。
| マグネシウム(Mg)|12|1s22s22p63s2|2|||。
| ホウ素(B)|5|1s22s22p1|3||||||。
| 炭素(C)|6|1s22s22p2|4||||||。
| 硫黄(S)|16|1s22s22p63s2 3p4|6|の順です。
周期表で同じグループの元素は、原子番号でグループ分けされ、電子配置を考えると最外殻に存在する電子の数が同じなので、同じ価数になる。
酸化状態とは
酸化状態とは、ある原子が失うか、得るか、あるいは他の原子と共有できる電子の数として定義することができます。
電子は負の電荷を帯びており、それぞれの負の電荷は原子核の陽子の正の電荷によって中和されるため、電子の損失または獲得によって原子の電荷が変化する。
原子が電子を失ったり得たりすると、電荷のバランスが崩れることになる。
したがって、その原子の酸化状態は、その原子の電荷を表している。
酸化状態は、化合物の中にある原子の電荷を表すのに使うことができます。
酸化状態は、正(+)または負(-)の記号と数字で表されます。
記号は原子の電荷を表し、数値は交換された電子の数を表します。
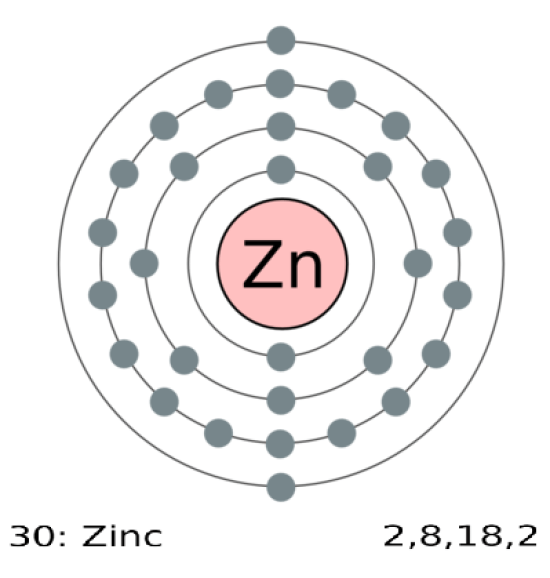 図2: 0と+2が亜鉛の唯一の酸化状態です。
図2: 0と+2が亜鉛の唯一の酸化状態です。
酸化状態の決定方法
原子の酸化状態は、7つのルールで計算されます。
以下にその法則と酸化状態の例を示す。
ルール1
元素の酸化状態は常にゼロです。
元素の形のままでは、酸化状態も0です。
例:ナトリウム(Na)の酸化状態は0、水素(H2)の酸化状態は0
ルール2
分子またはイオンの全電荷は、化合物を構成する各原子の電荷の合計でなければならない。
例:KCl の全電荷は 0
Kの電荷(酸化状態)は+1
Clの電荷(酸化状態)は-1です。
ルール3
1族元素の酸化状態は常に+1です。
ルール4
2族元素の酸化状態は常に+2です。
ルール5
負の電荷は、それに結合している他の原子に比べて最も電気陰性な原子に与えられます。
例:フッ素は最も電気陰性度の高い元素です。
したがって、他の元素と結合しているときは常に、フッ素の酸化状態は-1される。
ルール6
水素(H)の酸化状態は+1です。
しかし、1族金属と一緒になると、水素の酸化状態は-1です。
ルール7
酸素(O)の酸化状態は-2です。
しかし、過酸化物では、Oの酸化状態は-1です。
| 化合物|元素X|Xの酸化状態|を表す。 | ||
| NH3|X=N|-3|の酸化状態 | ||
| KMnO4|X = Mn|+7|の酸化状態 | ||
| Cr2O72-|X = Cr|+6|の酸化状態。 |
価数と酸化状態の違い
定義
価数。
価数は、特定の元素の最外殻に存在する電子の数として定義することができる。
酸化状態。
酸化状態は、特定の原子が他の原子から奪ったり、獲得したり、共有したりできる電子の数として定義されることがあります。
電荷
価数。
価数は、化合物中の原子の電荷を示すものではない。
酸化。
酸化状態は、化合物中の原子の電荷を示す。
ボンディング
価数。
原子価は、原子が持つことのできる結合の最大数を決定する。
酸化状態。
酸化状態は、特定の原子が持つことのできる結合の数を示さない。
純元素
価数。
純元素の価数は、原子(気体状態の原子)の最外殻にある電子の数によって決まる。
酸化状態。
純元素の酸化状態は常にゼロです。
結論
価数と酸化状態は、同じ値をとる場合と異なる値をとる場合があります。
価数とは、特定の元素の最外殻に存在する電子の数であり、酸化状態とは、特定の化合物中の元素が失ったり得たりした電子の数です。
これが価数と酸化状態の大きな違いです。
