主な違い – 電解質結合と共有結合
電解結合と共有結合は、分子または化合物の原子の間に見られる 2 種類の化学結合です。
これらの結合は、原子をつなぎ合わせるのに役立つ。
この2種類の結合の形成は、2つの原子間の電子の交換が原因で起こります。
電解質結合はイオン結合とも呼ばれます。
これは、2つの原子間の静電引力です。
共有結合は、2つの原子の間で電子を共有することによって生じます。
電解結合と共有結合の主な違いは、電解結合は2つの原子が静電気的な引力を持つときに形成されるのに対し、共有結合は2つの原子が互いの電子を共有するときに形成されることである。
電解結合とは
電解質結合とは、化学結合の一種で、2つの原子が静電気的な引力を持つ結合と定義できる。
ここで、2つの原子は完全に電子を失うか、または完全に電子を獲得する。
したがって、2つの原子はイオンになる。
電子を失った原子は陽イオンになり、電子を得た原子は陰イオンになる。
したがって、電子交換後の2つの原子は、反対電荷のイオンであるため、引力が発生する。
この引力が静電引力です。
この引力は、2つの原子を結びつけてイオン分子を形成するのに役立っています。
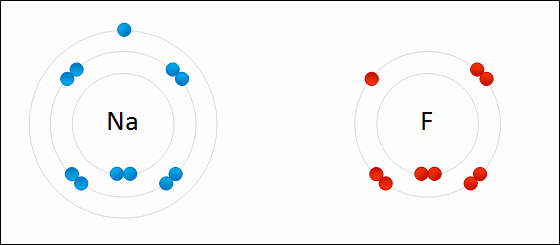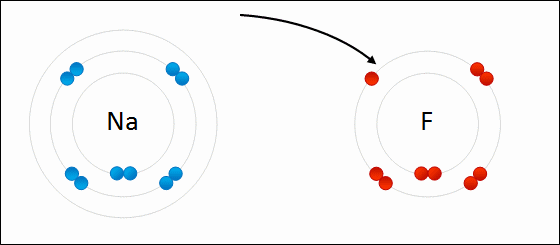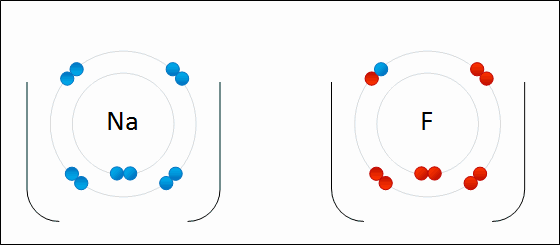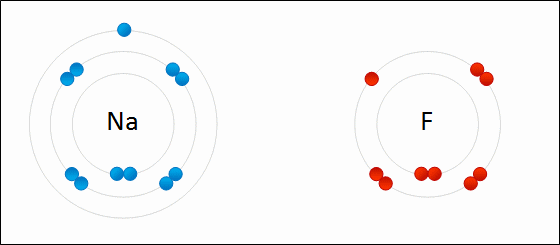 図01: 金属ナトリウム(Na)と塩素(Cl)のイオン結合のでき方
図01: 金属ナトリウム(Na)と塩素(Cl)のイオン結合のでき方
多くの場合、陽イオンは金属です。
これは、金属は軌道を埋めるために多くの電子を獲得するよりも、一番外側の軌道にある電子を失う傾向があるからです。
次に、陰イオンは非金属になります。
これは、非金属は一番外側の軌道にある電子をすべて失うよりも、電子を獲得する傾向があるからです。
このような結合を電解質結合と呼ぶのは、ここの原子は引力があるので完全に電子を失うことも得ることもなく、ある程度共有結合的な性格を持っているからです。
したがって、これは完全なイオン結合ではありません。
イオン結合の強さは、いくつかの要因に依存します。
- 陽イオンのサイズ – 陽イオンが陰イオンと比較して非常に小さい場合、イオン結合は非常に強力です。
- アニオンの大きさ – アニオンがカチオンに比べて非常に大きい場合、イオン結合は非常に強いです。
- イオンの電荷 – イオンの電荷が高ければ、イオン結合はより強くなります。
2 つの異なるイオン結合を比較する場合、まず電荷を考慮し、次にイオンの大きさを考慮する必要があります。
これらのイオン結合が原子間に形成されるのは、電子を除去または獲得することによって、最も近い希ガスの電子配置を得ることで自身を安定化させる必要があるためです。
このほぼ完全な電子移動は、これらの原子の電気陰性度の高い差によって引き起こされる。
電気陰性度の高い原子は、電気陰性度の低い原子よりも電子を引き寄せることになる。
共有結合とは?
共有結合は、2つの原子が電子を共有することによって形成される化学結合の一種です。
電気陰性度の差が1.7より小さい、あるいは全くない原子の間に形成される。
したがって、ほとんどの非金属は共有結合を形成している。
さらに、同じ元素の原子同士は、共有結合しか形成しない。
共有結合には、結合電子対と呼ばれる2つの電子が存在する。
この結合電子対は、各原子が提供する電子が対になって形成される。
各原子は1つの共有結合につき、1個の電子を提供する。
そのため、原子の中には、価電子の数に応じて複数の電子を提供できるものがあります。
その場合、これらの原子は2つ以上の共有結合を持つことになります。
したがって、炭素原子の周囲には4つの結合電子対が存在する。
共有結合を形成するためには、原子の一番外側の軌道に少なくとも1個の不対電子が必要である。
そして、この電子は、別の原子が共有する電子と対になることができる。
不対電子が存在する軌道によって、形成される結合はシグマ結合にもπ結合にもなる。
しかし、2つの原子の電気陰性度によって、共有結合は極性共有結合と非極性共有結合のどちらとしてでも存在することができる。
極性共有結合は、2つの電気陰性度の差が0.4〜1.7である場合に形成される。
しかし、電気陰性度の差が0.4単位しかない場合は、非極性共有結合です。
電荷結合と共有結合の類似性
- 電解結合と共有結合は、化学結合の一種です。
- どちらも2つ以上の原子の間で電子が交換されることにより形成される。
- どちらの結合も2つの原子が結合している。
電解質結合と共有結合の違い
定義
電解質結合:電解質結合は化学結合の一種であり、2つの原子間の静電引力として定義される。
共有結合:共有結合は、2つの原子間の電子共有によって形成される化学結合の一種である。
債券の性質
電解質結合:電解質結合は2つの原子間の静電引力の一種である。
共有結合: 2つの原子が直接化学的に結合すること。
電気陰性度
電解質結合:原子の電気陰性度の差が1.7以上であれば電解質結合が形成される。
共有結合: 原子の電気陰性度の差が1.7より小さいと共有結合を形成する。
イオンと原子の比較
電解質結合:イオンは電解質結合の形成に関与する。
共有結合:原子は共有結合の形成に関与する。
結論
化学結合の一種に電荷結合と共有結合がある。
これらの結合は、原子間の電子交換によって形成される。
1 つの原子が複数の電 気価または共有結合を持つことができます。
電解結合と共有結合の主な違いは、電解結合は2つの原子が静電気的な引力を持つときに形成され、共有結合は2つの原子が互いに電子を共有するときに形成されることである。
