塩酸と硫酸の主な違い
酸とは、水溶液にプロトンまたはH+イオンを供与することができる分子です。
酸には、主に強酸と弱酸の2種類があります。
塩酸と硫酸は強酸の一種です。
塩酸と硫酸の主な違いは、塩酸が単プロトン性であるのに対し、硫酸は二プロトン性であることです。
塩酸とは?
塩酸の分子は、水素(H)原子と塩素(Cl)原子から構成されています。
塩酸の化学式はHClと示される。
HClのモル質量は約36.5g/molです。
この酸は、HClガスが水に溶けた無色の溶液です。
強酸であるため、腐食性があり、取り扱いには注意が必要です。
HClは、HCl1分子あたり1個のH+イオンを供与することができ、つまり単プロトン性(プロトンを1個放出することができる)です。
HClと水との反応は以下のように与えられる。
HCl+H2O→Cl-+H3O+となる。
HClは、酸解離定数値(Ka)が大きい。
この酸は、滴定によって塩基の濃度を求めるときに使われる。
これは、Kaが大きいために容易に解離し、Cl-イオンが塩基の陽イオンと塩を形成するためです。
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
上記の反応において、NaOHは塩基であり、NaClはその反応から生成する塩です。
それとは別に、塩酸は穏やかな還元剤です。
MnO2のような強い酸化剤とは酸化還元反応を起こします。
MnO2(aq)+HCl(aq)→MnCl2(aq)+Cl2(g)+H2O(l)となります。
硫酸とは?
硫酸は、水素(H)、酸素(O)、硫黄(S)原子からなる強酸です。
硫酸の分子式は H2SO4 と示されます。
硫酸は二液性酸です。
つまり、1分子につき2個のプロトンを放出することができます。
硫酸のモル質量は約98g/molです。
非常に腐食性の高い溶液です。
しかし、腐食性はその濃度に依存する。
非常に低濃度であれば害はない。
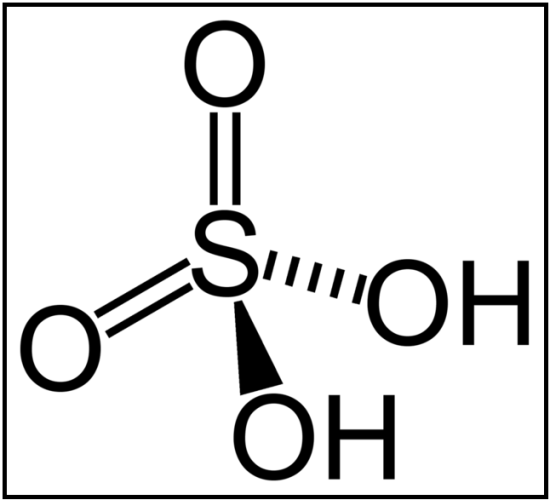 図01:硫酸の化学構造
図01:硫酸の化学構造
硫酸分子は2つの-O-H結合を持ち、この結合は非常に極性が高い。
この極性により、H原子は容易に消失する。
硫酸のイオン化は2つのステップで行われます。
H2SO4(aq) + H2O(l) → HSO4-(aq) + H3O+(aq)
HSO4-(aq)+H2O(l)→SO4-2(aq)+H3O+(aq)となります。
硫酸は濃厚な状態では強い酸化剤です。
しかし、希釈すると酸化力が弱くなる。
例えば、高温では、濃硫酸はBr-をBr2に酸化することができます。
2HBr(aq) + H2SO4(aq) → Br2(aq) +SO2(aq) + 2 H2O(l)
塩酸と硫酸の違い
定義
塩酸のこと。
塩酸は、水素原子と塩素原子からなる強酸です。
硫酸 水素原子、硫黄原子、酸素原子からなる強酸。
モル質量
塩酸の場合 塩酸のモル質量は約36.5g/molです。
硫酸 硫酸のモル質量は、約98g/molです。
プロトン発売
塩酸 塩酸は一価で、1分子につき1個のプロトンを放出する。
硫酸。
硫酸は二液性であり、1分子につき2個のプロトンを放出する。
OH基の有無
塩酸の場合 塩酸には-OH基はありません。
硫酸 硫酸は-OH基を2つ持つ。
化学的性質
塩酸。
塩酸は穏やかな還元剤です。
硫酸 強い酸化剤です。
結論
塩酸と硫酸の主な違いは、塩酸が単プロトン性であるのに対し、硫酸は二プロトン性であることです。
塩酸も硫酸も実験室での実習では非常に重要です。
酸であるため、取り扱いには注意が必要です。
