主な違い – 共有結合と水素結合
化学結合は、原子と原子の間に生じる結合です。
これらの化学結合は、分子や複雑な化合物を形成するために原子をつなぎ合わせるのに役立っています。
化学結合は、原子間の電子の交換、または原子、イオン、分子間の引力のいずれかによって形成されます。
共有結合と水素結合は、共有結合を持つ化合物の間に見られる2種類の化学結合です。
共有結合は、原子間の電子の共有によって形成される。
水素結合は、2つの異なる分子の2つの原子が引き合うことによって形成される。
共有結合と水素結合の主な違いは、共有結合が分子内の引力であるのに対して、水素結合は分子間の引力であることである。
共有結合とは?
共有結合は、原子間の電子の共有により形成される化学結合です。
そのため、分子間引力と呼ばれる。
結合は、不対電子を含む2つの原子の間で形成される。
これらの不対電子は、別の原子の不対電子と対になって、共有結合を形成します。
原子は、原子間の結合として、単結合、二重結合、三重結合のいずれかを持つことができる。
1つの共有結合は1つの結合電子対からなり、1つの不対電子が別の原子の不対電子と結合すると共有結合が形成され、この2つの電子を結合電子対または結合対と呼ぶ。
したがって、二重結合では、2つの結合対を持つ共有結合が2つあるため、4個の電子が2つの原子の間で共有されていることになります。
共有結合を形成する主な目的は、原子の最外周の軌道を埋めて安定化させることである。
共有結合は、非金属と金属元素の間で見られる。
共有結合は非常に強い引力であり、共有結合の強さは100から1100 kJ/molの範囲にある。
上の図は、水素(H)原子とフッ素(F)原子の共有結合を表しています。
ここで、十字マークは水素原子の不対電子を、ドットマークはフッ素の最外周軌道にある電子を表しています。
共有結合には、大きく分けて極性共有結合と非極性共有結合があります。
この2つの結合は、共有結合の極性によって名前がつけられている。
結合の極性は、共有結合に寄与する2つの原子の電気陰性度の値によって決まる。
これらの電気陰性度の値の差が0.4未満であれば、非極性共有結合です。
この値が0.4〜1.7であれば、極性共有結合です。
上の例では、水素の電気陰性度は2.2、フッ素の電気陰性度は4.0です。
したがって、その差は (4.0-2.2) = 1.8 となる。
したがって、これは極性の高い共有結合です。
水素結合とは
水素結合は、異なる2つの分子の2つの原子の間に発生する引力です。
したがって、分子内引力です。
弱い引力です。
しかし、極性-極性相互作用、バンダーワール力のような非極性-非極性相互作用など、他のタイプの分子内力と比較すると、水素結合はより強いです。
水素結合は極性を持つ共有結合性化合物の間で起こります。
これらの化合物(または分子)は極性共有結合で構成されている。
極性共有結合は、共有結合を構成する原子の電気陰性度の値の差によって生じる。
この差が大きいと、電気陰性度の高い原子は、結合電子を自分の方に引き寄せる傾向があります。
これにより、電気陰性度の高い原子が部分的に負電荷を帯び、もう一方の原子が部分的に正電荷を帯びる双極子モーメントが発生します。
そして、この結合は極性を持った共有結合となる。
この分子が、このような双極子モーメントを持つ別の分子に出会うと、負と正の電荷は互いに引き合う傾向があります。
この引き合う力を水素結合と呼びます。
水素結合は、電気陰性度の高い原子と電気陰性度の低い原子の間で起こります。
水素結合は、ある分子にO、N、Fがあり、もう一方の分子に正の電荷を持つHがある場合に存在します。
これは、F、N、Oが水素結合を形成することができる最も電気陰性度の高い原子であるためです。
水素結合の強さは5〜50 kJ/molの範囲で変化します。
最も強い水素結合は、HF原子間で発生する。
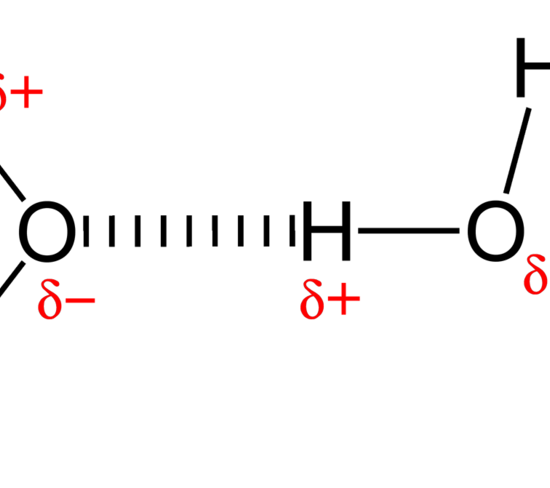 : 図2: 水分子間の水素結合
: 図2: 水分子間の水素結合
水素結合を持つ化合物としては、水が最も一般的な例です。
このとき、水分子の酸素原子は、分子内の電荷分離により、他の分子の水素原子を引きつけることができる。
共有結合と水素結合の類似点
- 共有結合と水素結合は化学結合の一種です。
- どちらの結合も2つの原子の間に発生する。
- どちらの結合も、2つの原子の間の接着剤として作用する。
共有結合と水素結合の違い
定義
共有結合。
共有結合は、原子間の電子の共有によって形成される化学結合です。
水素結合。
水素結合は、2つの異なる分子の2つの原子の間に発生する引力です。
債券の性質
共有結合。
共有結合は分子間の化学結合です。
水素結合。
水素結合は、分子内化学結合です。
化学種
共有結合。
共有結合は2つの原子の間に形成される。
水素結合。
水素結合は、2つの異なる分子の2つの原子の間に形成されます。
ボンド強度
共有結合。
共有結合の結合強度は100~1100kJ/molの範囲で変化する。
水素結合。
水素結合の結合強度は5〜50kJ/molの範囲で変化する。
結論
共有結合と水素結合はどちらも化学結合です。
共有結合は、水素結合よりも強い。
これは、共有結合が2つの原子間の電子の共有によって形成されるのに対し、水素結合は2つの分子間の引力によって形成されるからです。
共有結合と水素結合の主な違いは、共有結合が分子内引力であるのに対し、水素結合は分子間引力であることである。
