主な違い – 酸化数 vs 価数
酸化数と価数は、原子の価電子と関係があります。
価電子とは、原子の最も外側の殻や軌道を占める電子のことです。
これらの電子は原子核に弱く引きつけられるため、他の原子と容易に脱落したり共有したりすることができる。
この電子の損失、獲得、共有により、特定の原子は酸化数と価数を持つようになる。
酸化数と価数の主な違いは、酸化数が配位化合物の中心原子の電荷(その原子の周りの結合がすべてイオン結合である場合)であるのに対し、価数は原子が安定になるために失う、得る、共有できる電子の最大数であることである。
酸化数とは
酸化数とは、配位化合物の中心原子の周りの結合がすべてイオン結合であった場合の電荷のことです。
配位錯体は、ほとんどの場合、中心に遷移金属原子があります。
この金属原子の周囲を配位子と呼ばれる化学基が取り囲んでいます。
配位子は単独電子対を持っており、金属原子と共有することで配位結合を形成することができます。
配位結合が形成された後は、共有結合と同じような状態になります。
これは、配位結合中の2つの原子が、共有結合と同じように一対の電子を共有しているからです。
ただし、中心金属原子の酸化数は、配位結合をイオン結合とみなして計算される。
配位結合を形成するためには、金属原子が空の軌道を持つ必要がある。
遷移金属の多くは、空のd軌道で構成されています。
したがって、これらは配位錯体の中心金属原子として働くことができる。
中心原子の酸化数は、ローマ数字で表される。
ローマ数字は中心原子の電荷を示すもので、括弧内に含まれる。
例えば、仮想の金属原子「M」の酸化数が3であれば、酸化数はM(III)と示される。
酸化数を求める例を考えてみよう。
配位イオンの構造を以下に示します。
上記の配位イオンでは、全体の電荷が+1であるため、配位子と中心原子の電荷の和は+1になるはずです。
一般的に、塩素原子は-1の電荷を持ち、NH3は中性です。
+1 = (コバルト原子の電荷) + (2個の塩素原子の電荷) + (4個のNH3原子の電荷)
+1 = (コバルト原子の電荷) + (-1 x 2) + (0 x 4)
したがって
コバルト原子の電荷=(+1)-{(-2)+(0)}となります。
= (+3)
したがって、コバルトの酸化数=Co(III)
Valencyとは
原子価とは、原子が安定するために失う、得る、または共有することができる電子の最大数のことです。
金属や非金属の場合、八分則は原子の最も安定な形を記述している。
これは、原子の最外殻の数が8個の電子で完全に満たされていれば、その配置は安定であるというものです。
つまり、sとpの副軌道がns2np6で完全に満たされていれば、安定なのです。
当然ながら、希ガス原子はこの電子配置をしている。
したがって、他の元素は八重項則に従うために、電子を失うか、獲得するか、共有する必要がある。
この安定化に関与する電子の最大数を、その原子の価数と呼ぶ。
例として、シリコン元素を考えると、電子配置は1s22s22p63s23p2です。
一番外側の殻はn=3です。
その殻にある電子の数は4個なので、あと4個の電子を得て八重項を完成させる必要がある。
一般に、シリコンは4個の電子を他の元素と共有して、8重項を完成させることができます。
Then the sharing of electrons occurs.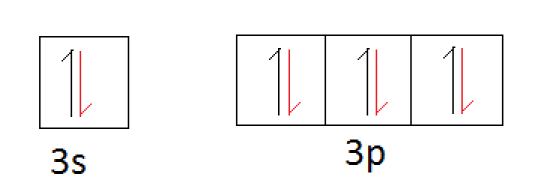
上の軌道図において、赤色の半矢印は他の元素が共有する電子を表しています。
シリコン原子が安定化するためには4個の電子を共有する必要があるので、シリコンの原子価は4となります。
これは、軌道のエネルギー準位に応じて、電子が軌道に充填されるからです。
例えば、アウフバウの法則によれば、4s軌道のエネルギーは3d軌道のそれよりも低い。
そこで、電子はまず4s軌道に、次に3d軌道に充填される。
原子価は一番外側の軌道にある電子に対して定められるので、4s軌道にある電子がその原子の原子価になる。
鉄(Fe)を考えると、電子配置は[Ar]3d64s2です。
したがって、鉄の原子価は2(4s2の電子が2個)です。
しかし、鉄の価数が3価になることがあります。
これは、3d5の電子配置が3d6よりも安定だからです。
したがって、4s電子と一緒にもう1個の電子を取り除くと、鉄はより安定化する。
酸化数と原子価の違い
定義
酸化数。
酸化数とは、配位化合物の中心原子の電荷で、その原子の周りの結合がすべてイオン結合であった場合の電荷です。
価数。
原子価は、原子が安定化するために失う、得る、または共有することができる電子の最大数です。
アプリケーション
酸化数。
配位錯体の場合,酸化数を適用する。
価数 任意の元素の価数を使用します。
計算方法
酸化数。
配位子と配位錯体全体の電荷を考慮して酸化数を計算することができる。
価数 電子配置を求めることで価数を決定することができる。
代表的なもの
酸化数。
酸化数は括弧内のローマ数字で表示されます。
価数。
価数はヒンドゥー・アラビア数字で表示されます。
結論
価数の定義では、結合に使われる電子の最大数となっていますが、遷移元素は異なる価数を持つことがあります。
これは、遷移金属は異なる数の電子を取り除くことで安定化させることができるからです。
また、配位錯体の中心原子は、結合している配位子によって異なる酸化数を持つことがあります。
