主な違い – 同位体 vs 同位体
化学元素の原子は、常に電子雲に囲まれた原子核で構成されています。
原子核は、陽子と中性子で構成されています。
ある元素の原子に存在する陽子の数は常に同じです。
つまり、陽子の数は化学元素の固有の性質です。
しかし、原子核に存在する中性子の数は、同じ元素の原子でも異なることがあります。
このような異なる形態のものを同位体と呼びます。
ある元素の原子質量は、その元素の原子核に存在する陽子と中性子の合計です。
原子番号が異なる元素であっても、原子質量が同じになることがあります。
このような異なる形のものを同位体と呼びます。
同位体と等質体の主な違いは、同位体の原子質量が互いに異なるのに対し、等質体の原子質量は互いに似ていることである。
同位体とは
同位体とは、同じ元素の異なる原子構造のことです。
つまり、同位体は原子番号が同じで、原子質量が異なるということです。
これは、原子番号が、原子核に同じ数の陽子が存在することによる、化学元素に固有の性質であるためです。
しかし、原子質量は原子核に存在する中性子の数に依存し、同位体は中性子の数が異なるため、同位体の原子質量は互いに異なる場合があります。
元素の化学的性質は、ほとんどが原子に存在する電子に依存するため、同位体は化学的性質に類似性を示す。
元素の同位体は、同じ数の電子と同じ電子配置を持っています。
同位体の物理的性質は互いに異なる場合があります。
一般に、物理的性質は原子量に依存し、同位体は異なる原子量を持つ。
同位体の例としては、水素、ヘリウム、炭素、リチウムなどの同位体が挙げられます。
上の図は、自然界に存在するヘリウムの同位体の原子構造を示しています。
ここで、1つのヘリウムの同位体は中性子1個で構成されており、もう1つの同位体は中性子2個で構成されています。
しかし、両者とも原子番号は同じ2ですが、原子質量は異なっています。
アイソバーとは
等質線とは、同じ原子量を持つ化学元素のことです。
化学元素の原子質量は、陽子と中性子の数の和で与えられます。
陽子や中性子を単独で核子と呼びます。
したがって、核子の数は原子質量に等しい。
したがって、アイソバーは核子の数が同じです。
しかし、陽子と中性子だけの数は、等質線では常に互いに異なっています。
等質線は同じ数の電子で構成されています。
このことは、等質線が同じ化学的性質を示すことを示しています。
また、原子量も同じなので、物理的性質も同じです。
原子番号が異なるので、アイソバーは異なる化学元素となります。
例:原子量64の等圧元素の系列。
- コバルト(Co)
- ニッケル(Ni)
- 銅(Cu)
- 鉄(Fe)
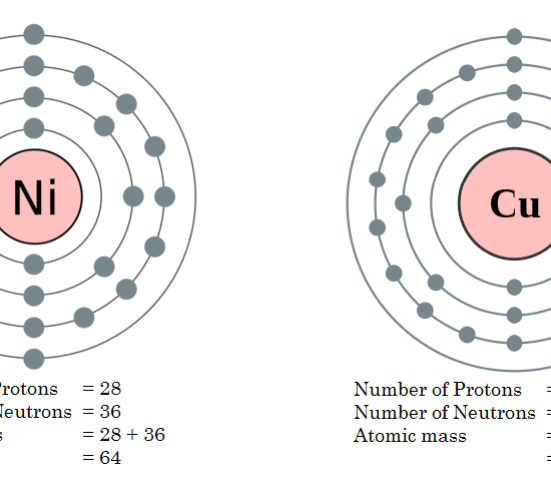 図2: 銅とニッケルの原子量
図2: 銅とニッケルの原子量
原子量3を持つ同位体。
- 水素(H)
- ヘリウム(He)
同位体とアイソバーの違い
定義
同位体。
同位体とは、同じ元素の異なる原子構造のこと。
同位体。
同位体とは、同じ原子量を持つ化学元素のこと。
原子番号
同位体。
同位体の原子番号は互いに等しい。
同位体。
同位体の原子番号は互いに異なる。
原子質量
同位体。
同位体の原子質量は互いに異なる。
同位体。
同位体の原子質量は互いに等しい。
化学元素
同位体。
同位体とは、同じ化学元素が異なる形で存在すること。
同位体。
同位体とは、異なる化学元素のこと。
物性値
同位体。
同位体では物理的性質が異なる。
同位体。
ほとんどの物性は同位体で類似している。
結論
同位体や等圧線は、化学元素の関係を示す例です。
同位体とは、同じ化学元素の異なる形態のことである。
同位体とは、同じ元素の異なる形態のことであり、等圧線とは、同じ性質を持つ異なる元素間の関係のことである。
そのため、同位体と等質体の違いを理解することは非常に重要です。
