乳酸と乳酸脱水素酵素の大きな違いは、乳酸の脱プロトン化体であるL-乳酸が激しい運動時に筋肉内で生じる嫌気性解糖の副産物であるのに対し、乳酸脱水素酵素は乳酸とピルビン酸の相互変換を司る酵素である点です。
乳酸と乳酸脱水素酵素は、体内の嫌気性条件下での代謝に関連する化合物の2つの形態です。
乳酸アシドーシスは、血液中に乳酸が蓄積された状態です。
また、乳酸脱水素酵素は、心疾患、腎疾患、肝疾患、骨格筋疾患など様々な疾患で上昇することが知られています。
乳酸とは
乳酸は有機化合物の一種で、水に非常に溶けやすい。
乳酸は乳酸の抱合体で、乳酸が脱プロトン化したものです。
乳酸は、体内の細胞内で嫌気的条件下で生成される。
乳酸発酵は、乳酸が生成される過程です。
通常の好気性呼吸と比較すると、少量のATPが生成される。
ここで、ピルビン酸は好気性解糖の副産物であり、乳酸は嫌気性解糖の副産物です。
したがって、激しい運動などで酸素の供給が著しく制限された場合、乳酸発酵が筋肉を活性化し、疲労を遅延させ、傷害を予防することができる。
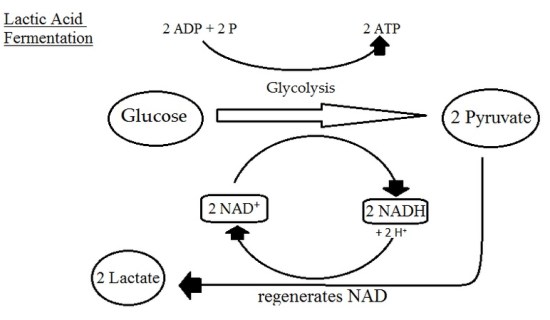 :図1 乳酸発酵の様子
:図1 乳酸発酵の様子
しかし、酸素が不足すると、NADHの蓄積に応じて、一部のピルビン酸も乳酸に変換される。
それでも、細胞は余分な乳酸を血液中に放出する。
したがって、血中の乳酸濃度の上昇は、低酸素の酸素欠乏の初期症状であるといえる。
血液中の乳酸が上昇した状態を乳酸アシドーシスという。
A型乳酸アシドーシスは組織の酸素化の障害によって起こり、B型乳酸アシドーシスは毒素による、細胞代謝の障害によって起こる。
乳酸脱水素酵素とは?
乳酸脱水素酵素(LDH)は、乳酸とピルビン酸の相互変換を担う酵素です。
補酵素NADを利用して、2つの化合物の間で水素を移動させる。
この酵素は、体内のほぼすべての細胞に存在する。
しかし、肝臓、心臓、骨格筋、腎臓、赤血球で活性が高い。
例えば、肺、平滑筋、脳では活性が低い。
また、心不全、腎臓、肝臓、骨格筋などの疾患では、血中の乳酸脱水素酵素の濃度が高くなることがあります。
図2:乳酸脱水素酵素の働き
乳酸脱水素酵素には、LDH-1、LDH-2、LDH-3、LDH-4、LDH-5という5種類のアイソフォームがあります。
LDH-1とLDH-2は心臓と赤血球に多く、LDH-3はリンパ組織、肺、膵臓、血小板に多く、LDH-4と肝臓、骨格筋にはLDH-5が多く含まれています。
血中の乳酸脱水素酵素の正常値は成人で100-190U/Lでなければならない。
しかし、遺伝子の変異により、体内の乳酸脱水素酵素の濃度が低くなってしまう。
この酵素のレベルが低い人の中には、疲労感や筋肉痛を感じる人もいます。
また、アスコルビン酸を大量に摂取すると、乳酸脱水素酵素の濃度が低下することがあります。
乳酸と乳酸脱水素酵素の類似点
- 乳酸と乳酸脱水素酵素は、体内の嫌気性解糖に関連する2つの化合物です。
- 乳酸と乳酸脱水素酵素は、体内の嫌気性解糖に関連する化合物で、激しい運動時など、特定の組織への酸素供給が極度に制限された場合に発生します。
- また、両者は体内のあらゆる種類の細胞で起こり得ますが、骨格、心臓、肝臓、腎臓、赤血球でより頻繁に起こります。脳、平滑筋、肺では発生頻度が低い。
乳酸と乳酸脱水素酵素の違い
定義
乳酸とは、酸乳類に含まれる無色の水飴状の有機酸で、激しい運動をしたときに筋肉組織で生成されるもの。
これが、乳酸と乳酸脱水素酵素の根本的な違いです。
意義
さらに、乳酸と乳酸脱水素酵素の大きな違いは、乳酸が組織での嫌気性解糖の副産物であるのに対し、乳酸脱水素酵素は乳酸とピルビン酸の相互変換を行う酵素であることである。
重要性
血液中に乳酸がある状態を乳酸アシドーシスというが、乳酸脱水素酵素の値が高くなるのは、心疾患、腎疾患、肝疾患、骨格筋疾患などさまざまな病気で起こる。
したがって、これも乳酸と乳酸デヒドロゲナーゼの違いです。
結論
乳酸は、酸素供給が著しく制限された場合に、体内組織体内の嫌気性解糖によって生成される化合物です。
乳酸脱水素酵素は、乳酸とピルビン酸の相互変換を担当する酵素です。
ほとんどの体細胞で発生する。
しかし、乳酸と乳酸デヒドロゲナーゼの大きな違いは、その意義にある。
