主な相違点 – 極性分子と非極性分子
異なる元素や同じ元素の原子が集まって分子を形成しています。
2つの原子が1組の電子を共有することによって形成される結合を「共有結合」と呼びます。
原子の種類によって、電子に対する吸引力の強さはさまざま。
電子を引き寄せる力を「電気陰性度」といいます。
F、Cl、Oなどの原子は、C、P、Sなどの原子に比べて大きな電気陰性度を示します。
電気陰性度の差が0.4<の原子が結合すると、極性分子が形成されます。
電気陰性度の差が0.4未満の場合、分子は非極性になる。
極性分子と非極性分子の主な違いは正味の双極子モーメントです。
正味の双極子モーメントは極性分子の原子に形成されるが、非極性分子には形成されない。
この記事で説明する。
-
極性分子とは
– 定義、生成、物性、例題 -
非極性分子とは
– 定義、生成、性質、例題
極性分子とは
極性分子は、電気陰性原子の結果として、あるいは同一分子上に非極性結合と孤立電子対が非対称に配置されることによって形成されます。
以下の例では、この2つの現象についてより詳しく説明する。
Water Molecule: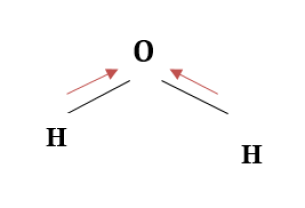
HとOの電気陰性度はそれぞれ2.20と3.44です。
この値の差は1.24であり、極性結合を形成する主な条件を満たしています。
電子は比較的大きな電気陰性度を持つO原子の方に引き寄せられる。
その結果、分子には正味の双極子が存在することになります。
O原子はわずかに負(δ-)、H原子はわずかに正(δ+)と言われています。
分子の極性を決めるには、分子の形も大きな役割を果たす。
ここでは、二酸化炭素の分子を例にとって、このシナリオをより深く理解することにしよう。
CはOよりも電気陰性度の低い原子(2.55と3.44)で、電気陰性度の差0.4という条件を満たしている。
しかし、分子の形状から、両方のC-O結合の双極子モーメントは反対方向にあり、互いに打ち消し合っている。
したがって、正味の双極子モーメントはゼロです。
極性分子は、一緒にいると、その原子の反対電荷を介して互いに引き合う。
この力は、非極性分子間の力よりも強いですが、イオン力ほど強くはありません。
プラスに帯電したH原子は、マイナスに帯電したO原子と水素結合を作る。
水素原子が関与する場合は水素結合と呼ばれ、水素原子が関与しない分子間力は双極子-双極子力と呼ばれる。
極性分子は、非極性溶媒と引力を形成できないので、極性溶媒にのみ溶解する。
極性化合物は、分子量の近い非極性化合物に比べ、融点や沸点が高い。
分子間結合を切断するためには、エネルギーを供給する必要がある。
そのため、融点や沸点が高くなる。
その結果、蒸気圧が低くなり、蒸発速度が非極性分子に比べて遅くなる。
さらに、極性分子は表面張力が大きい。
非極性分子とは?
極性分子とは異なり、非極性分子には負や正の電荷がない。
これは、2つの原子が共有する電子に対して同じような引力を持つためです。
2つの原子の電気陰性度の差は0.4以下です。
したがって、電子対は原子の間に均等に分布している。
同じ元素の二原子ガスは、ほとんどが無極性分子です。
例:- O2、N2、Cl2など。
メタン、ペンタン、ヘキサンのような炭化水素分子は非極性分子です。
非極性分子は、電子の非対称な分布によって引き起こされるロンドン分散力を示す場合があることに注意する必要がある。
これは自発的かつ一時的な力であり、すべての分子間力の中で最も弱い力です。
非極性分子を非極性溶媒に溶かすには、このロンドン力だけで十分です。
しかし、これらの力は極性双極子力よりも弱いので、非極性分子を極性溶媒に溶かしても混ざり合わない。
その代わり、不均質な系が形成されることになる。
この場合、溶解プロセスはエネルギー的に有利にはならない。
同じ分子量の極性分子と比較すると、非極性分子は強い分子間力がないため、融点や沸点が低くなる。
さらに、分子を容易に蒸発させることができるため、非極性化合物は高い蒸気圧を示す。
したがって、ほとんどの非極性分子は揮発性化合物を形成する。
例:ペンタン、ヘキサン
極性分子と非極性分子の違い
ネットダイポール
極性分子。
参加原子の電気陰性度の違いや分子の非対称な配置により正味の双極子が存在する。
非極性分子。
電気陰性度の近い原子が関与しているか、対称的な配置のため正味の双極子は存在しない。
電気陰性度の違い
極性分子。
原子間の電気陰性度の差が0.4以下です。
非極性分子。
原子間の電気陰性度の差が0.4以上です。
分子力
極性分子。
分子間力はやや強く、H-結合や双極子-双極子結合を形成する。
非極性分子。
分子力は最も弱く、ロンドン分散力を形成する。
物性値
極性分子。
極性分子は、沸点、融点が高く、蒸気圧が低く、表面張力が高い。
非極性分子。
非極性分子:沸点、融点が低く、蒸気圧が高く、表面張力が低い。
例
極性分子。
例:水、HF、CHF3など。
非極性分子。
ペンタン、ヘキサン、二酸化炭素など。
“分子 – 形成” 原子、分子、物質、および種類 – JRank記事。
“水処理ソリューション”. LENNTECH. N.p., n.d. Web. 02 Feb. 2017.
“極性分子と非極性分子。
“非極性分子の特性とは?| ソクラテス.”. Socratic.org. N.p., n.d. Web. 02 Feb. 2017.
“ロンドン分散力”. London Dispersion Forces. N.p., n.d. Web. 02 Feb. 2017.
“非極性は非極性を溶かす?”. Chemical Forums. N.p., n.d. Web. 02 Feb. 2017.
画像提供:
“Figure 02 01 11” By CNX OpenStax ( CC BY 4.0 ) via Commons Wikimedia
