主な違い – 浸透圧と浸透圧の違い
浸透圧は、流体に関する用語です。
浸透を避けるために必要な圧力のことです。
つまり、浸透圧とは、純粋な溶液が、溶質を溶かした溶液に浸透してしまうのを避けるために必要な圧力のことです。
浸透圧に関係するものとして、オスモラリティとオスモラリティがあります。
これらは浸透圧をオスモルという単位で測定するために用いられる。
オスモルとは、浸透圧に寄与する化合物のモル数です。
浸透圧と浸透率の大きな違いは、浸透圧が溶液の体積を考慮した測定値であるのに対し、浸透率は溶液の質量を考慮した測定値であることである。
オスモラリティとは
浸透圧とは、対象となる溶液の1リットルあたりの浸透圧(オスモル)の数です。
つまり、浸透圧活性を示す溶液の濃度を表す言葉です。
つまり、Osmolarityは浸透圧を示す溶液の濃度ということになります。
浸透圧濃度ともいう。
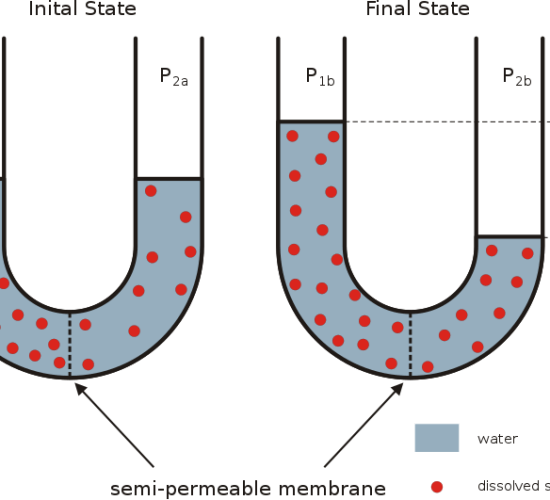 図1:浸透圧
図1:浸透圧
モル比とは異なり、浸透圧は1リットルあたりの粒子数を測定します。
例えば、NaCl溶液を考えた場合、浸透圧はその溶液のモル数の2倍で示される。
これは、モラリティが1リットルあたりのNaまたはClのモル数であるのに対し、浸透圧はすべての粒子を考慮するため、1リットルあたりの(Na+Cl)モル数であるためです。
イオン性化合物の溶液を考える場合、特定のイオンではなく、すべてのイオンを粒子として考える。
粒子はイオンでも分子でもよい。
しかし、分子構造を持つ化合物の溶液を考えた場合、化合物が溶けて分子を形成する。
このとき、それぞれの分子は粒子とみなされる。
例えば
- 1リットルの水に0.08モルのブドウ糖が溶けている場合。
グルコース溶液のモル数=0.08mol/L
グルコース溶液のオスモル濃度=0.08 osmol/L
- 1リットルの水に0.08モルのNaClが溶けている場合。
NaCl溶液のモル数=0.08mol/L
NaCl溶液のモル数=0.08mol/L NaCl溶液のオスモル数=0.16オスモル/L
オスモル比は、溶液に溶けている化合物の種類には依存しません。
そこに存在する粒子の量を測定しているだけです。
しかし、溶媒(水)の変化には影響される。
それは、溶液の体積が増減すれば、それに応じて浸透圧の計算で考慮する体積も変わるからです。
さらに、浸透圧は温度や圧力にも依存します。
化合物の体積や溶解度は、これらのパラメータを変更することで変化するからです。
オスモラリティとは
浸透圧とは、溶液の浸透圧を溶液の質量で表した言葉です。
溶液1キログラムあたりのオスモル数として定義されることがあります。
オスモルは、その溶液中に存在する粒子のモル数です。
粒子はイオンでも分子でもかまいません。
質量は圧力と温度に依存しないので、この2つのパラメータが溶液の浸透圧に影響を与えることはありません。
しかし、水分が変化すると、溶液の質量が変化するため、浸透圧に大きな影響を与える可能性があります。
この性質は、どのような温度、圧力条件でも正確に浸透圧を測定するのに有利です。
浸透圧は凝固点降下法で容易に求めることができる。
凝固点降下法は、溶質と溶液の凝固点の間接的な比例関係(溶液中の溶質が多いほど凝固点は低くなる)に基づいている。
図2:化合物を水に溶かすと浸透圧が発生する。
浸透圧の単位はosmol/kg。
浸透圧は、溶液中の溶質の濃度を溶液の質量で表したものです。
酸素濃度と浸透圧の関係
- 非常に希薄な溶液では、浸透圧と浸透圧は数値上同じになります。
- オスモラリティとオスモラリティの差はオスモラギャップと呼ばれる。
オスモラリティとオスモラリティの違い
定義
オスモル濃度。
オスモラリティとは、溶液の濃度を溶液1リットルあたりの溶質粒子のオスモル数で表したものです。
Osmolality:浸透圧。
浸透圧は、1キログラム当たりの溶質粒子の総数で表される溶液の濃度です。
計算方法
オスモル濃度。
浸透圧は溶液の体積から計算する。
Osmolality:浸透圧。
Osmolality: Osmolarityは、溶液の質量を考慮して計算されます。
単位
オスモル濃度。
浸透圧の単位はmol/Lです。
Osmolality:浸透圧。
浸透圧の単位はosmol/L。
温度と圧力
オスモル比。
浸透圧は温度と圧力に依存する。
Osmolality: 浸透圧は温度と圧力に依存しない。
結論
浸透圧を求めるには、浸透圧とオスモラリティの両方が使われます。
両者は溶液の濃度をオスモルで表します。
しかし、この記事で上述したように、両者にはいくつかの違いがあります。
浸透圧と浸透率の主な違いは、浸透圧が溶液の体積を考慮して測定されるのに対し、浸透率は溶液の質量を考慮して測定されることです。
