主な相違点 – 疎水性分子と親水性分子
水は、私たちが知っているほとんどの化合物を溶解する溶媒としてよく知られている。
しかし、自然界に存在するすべての化合物は、水と混ざり合うことはありません。
水と混ざり合うことができる物質を親水性物質と呼び、水と混ざり合わない物質を疎水性物質と呼びます。
この現象は、主に水分子の極性に起因する。
非極性化合物は極性溶媒に溶けることができない。
ここで、「類は友を呼ぶ」ことを考えなければならない。
極性化合物は極性溶媒に溶ける。
非極性化合物は非極性溶媒に溶ける。
したがって、親水性物質が水に溶けるためには、極性である必要がある。
疎水性分子と親水性分子の大きな違いは、疎水性分子が非極性であるのに対して、親水性分子は極性であることである。
疎水性分子とは?
疎水性分子は、水に溶けない分子です。
したがって、これらの分子は水分子をはじく。
このような疎水性分子を疎水性分子と呼びます。
疎水性とは、その分子がどの程度疎水であるかを表すものです。
疎水性分子は非極性であるために疎水性を示す、言い換えれば疎水性分子は非極性です。
したがって、疎水性分子は、分子を非極性にすることができる長鎖炭化水素基で構成されていることが多い。
疎水性分子は、水に添加されると、水との接触を最小限にするために、ミセルと呼ばれる塊のようなものを形成する傾向があります。
しかし、この塊の周りには、水分子が配置され、カゴのような形になっている。
このとき、水分子間の水素結合が切断され、塊のための空間が作られる。
これは、化学結合が破壊されるため、吸熱反応となる。
さらに、塊ができることによって、系のエントロピーが減少する。
熱力学的な関係からすると
ΔG = ΔH – TΔS
ここで、ΔGはギブスの自由エネルギー
ΔHはエンタルピーの変化量
Tは温度
ΔSはエントロピーの変化です。
水に疎水性分子が加わると、ΔSは減少する。
したがって、TΔSの値は減少する。
吸熱反応であるため、ΔHは正の値となる。
従って、ΔGの値は大きな正の値になるはずです。
ΔGの値が正であることは、その反応が自発的でないことを示す。
したがって、疎水性分子が水に溶けることは非自発的です。
疎水性分子間で起こる相互作用は、疎水性分子が非極性分子であるため、Van Der Waal相互作用となる。
このような相互作用には、疎水性相互作用という具体的な名称が与えられている。
水中に存在する塊は、水との接触をさらに少なくするために、互いに相互作用して混ざり合う傾向があります。
この反応では、塊を取り囲む水分子間の水素結合が破壊されるため、エンタルピーの変化は正の値になる。
また、塊の中にあったカゴが分解されて疎水化物が解放されるため、系のエントロピーは増加する。
プロセス全体を考えると、ΔG値は負の値を得る。
したがって、疎水性結合の形成は自発的なものです。
親水性分子とは?
親水性分子とは、水に溶けることができる分子です。
つまり、親水性の分子は水の分子を引き寄せる。
分子の親水性は、親水性と表現することができる。
親水性分子は極性分子です。
水分子は極性分子であるため、極性分子は水に溶けることができる。
このような親水性の分子を親水性分子と呼びます。
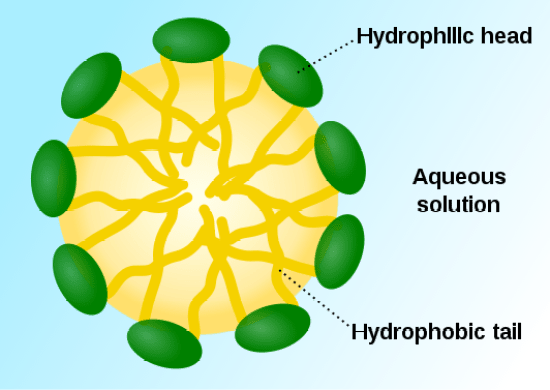 図1: ミセルの形成。
図1: ミセルの形成。
親水性分子が水を引き寄せるため、親水性分子は外側に向く。
親水性分子は、水分子と化学結合を形成することができる。
この親水性分子がO-H, N-Hのような結合で構成されている場合、水分子と水素結合を形成し、水と混ざり合うことが可能である。
ΔG = ΔH – TΔS
となり、親水性分子が水と混ざり合うことで系のエントロピーが増大し、その変化量ΔSは正の値となる。
親水性分子と水分子の間に新たな結合が形成されるため、この混合は発熱的です。
すると、エンタルピーの変化量は負の値となる。
したがって、ギブスの自由エネルギーは負の値となり、混合が自発的であることがわかる。
親水性分子の親水性は、これらの分子がどの程度水に溶けるかを決める。
分子の極性は、化学結合中の原子の電気陰性度の違いによって生じる。
この差が大きいと極性が高くなり、親水性が高くなる。
疎水性分子と親水性分子の違い
定義
疎水性分子。
疎水性の分子は、水に溶けない分子です。
親水性分子。
親水性分子は、水に溶ける分子です。
その他の名称
疎水性分子。
疎水性の分子を疎水性分子という。
親水性分子。
親水性の分子を親水性分子という。
水との相互作用
疎水性分子。
疎水性分子は水分子をはじく。
親水性分子。
親水性分子は、水分子を引き寄せる。
極性
疎水性分子。
疎水性分子は無極性です。
親水性分子。
親水性分子は極性を持つ。
ギブス自由エネルギー
疎水性分子。
疎水性分子:水に疎水性分子を加えると、ギブスの自由エネルギーは正の値になる。
親水性分子。
親水性分子:水に親水性分子を加えると、ギブスの自由エネルギーは負の値になる。
エントロピーの変化
疎水性分子。
疎水性分子:水に疎水性分子を加えると、エントロピーが減少する。
親水性分子。
親水性分子:水に親水性分子を加えると、エントロピーが増加する。
反応の種類
疎水性分子。
疎水性分子を水に溶かすのは吸熱反応です。
親水性分子。
親水性分子:親水性分子を水に溶かすと発熱する。
結論
分子は、水分子に対する反応によって、疎水性分子と親水性分子に分類される。
疎水性分子は水分子をはじく。
親水性分子は水分子を引き寄せる。
しかし、疎水性分子と親水性分子の決定的な違いは、疎水性分子が非極性であるのに対し、親水性分子は極性であることである。
