主な違い – 超共役 vs 共鳴
共有結合の化合物では、原子間に大きく分けて2種類の化学結合が観察される。
それは、シグマ結合とπ結合です。
単結合は常にシグマ結合です。
二重結合は、シグマ結合とπ結合からなる。
しかし、どちらの結合も原子軌道の重なりによって形成される。
分子を安定化させるための方法として、超共役と共鳴という言葉があります。
超共役と共鳴の主な違いは、超共役はシグマ結合とp軌道またはπ結合の相互作用があるのに対し、共鳴はπ結合の相互作用があることである。
ハイパーコンジュゲーションとは?
超共役とは、シグマ結合とπ結合の相互作用による分子の安定化効果です。
ここで、シグマ軌道は隣接する空のp軌道、部分的に充填されたp軌道、またはπ軌道と相互作用することになる。
この相互作用は、これらの軌道の重なり合いです。
その結果、拡張された分子軌道が形成され、結合電子に広い空間が与えられる。
そして、電子間の反発力が減少する。
その結果、分子は安定化する。
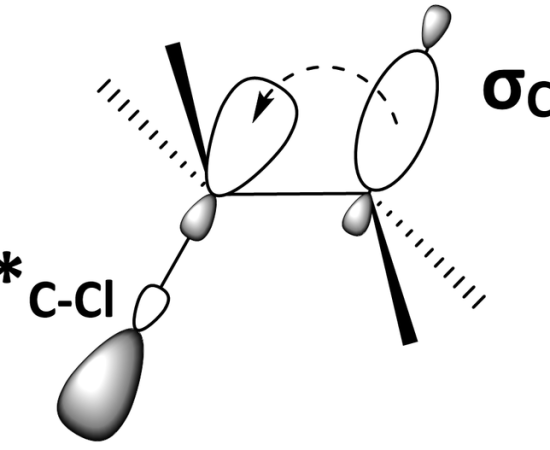
通常、C-Hシグマ結合の結合電子が隣接する炭素の2pまたはπ軌道と重なることで、超共役化が起こる。
図1:結合軌道(C-H)と反結合軌道(C-Cl)の重なり
超共役は化学結合の結合長に影響を与える。
通常、2つの原子間のシグマ結合は、同じ2つの原子間のπ結合よりも長くなる。
超共役によって、シグマ結合の長さは短くなり、π結合の長さは長くなる。
さらに、カルボカチオンの安定性を高めることができる。
共鳴とは
共鳴とは、π軌道上の結合電子の非局在化により分子を安定化させることである。
電子は原子や分子の中で決まった位置にあるわけではないので、簡単にあちこちに移動することができる。
そのため、安定化した状態を得るために、孤立電子やπ結合電子をある位置から別の位置へ移動させることができる。
これを共鳴という。
分子の最も安定な形を決定するために、ある分子が持ちうるすべての構造を示す共鳴構造を利用する。
共鳴構造は、電子の数が同じで、分子式も同じです。
また、分子内の原子の混成状態も、ローンペアの数とともに、すべての共鳴構造で同じでなければなりません。
 :図2 フェノールの共鳴構造
:図2 フェノールの共鳴構造
上の図は、フェノールのすべての可能な共鳴構造を示している。
共鳴構造の最後には、フェノール分子の元の構造が示されている。
これは、実際の分子が純粋な二重結合を持っていないことを示している。
3つの二重結合の代わりにπ電子雲が存在する。
したがって、共鳴は、共鳴構造の中間構造を与える。
超共役と共振の違い
定義
ハイパーコンジュゲーション(Hyperconjugation)。
シグマ結合とパイ結合の相互作用により、分子が安定化すること。
共振。
π軌道上の結合電子の非局在化により、分子を安定化させる効果。
関与した軌道
ハイパーコンジュゲーション。
超共役:シグマ結合軌道とp軌道またはπ結合軌道が関与する。
共鳴。
共鳴:π結合軌道のみを含む。
ボンド長
ハイパーコンジュゲーション。
ハイパーコンジュゲーションによりシグマ結合長が短くなる。
共振。
共振はシグマ結合に影響を与えない。
結論
超共役は共鳴の延長線上にあり、どちらも電子の非局在化によって分子を安定化させるが、超共役ではπ結合電子とともにシグマ結合電子も非局在化するのに対し、共鳴ではπ軌道間の相互作用によって非局在化を起こす。
これが超共役と共鳴の違いです。
