主な相違点 – 硫酸塩 vs 亜硫酸塩
中性原子や分子が外部から電子を獲得すると、電子がマイナスに帯電し、そのマイナス電荷を中和するだけのプラス電荷がないため、マイナス電荷種となる。
中性に帯電した原子や分子が電子を獲得すると、陰イオンと呼ばれる負に帯電した種になる。
硫酸塩や亜硫酸塩がそのような陰イオンです。
硫酸塩と亜硫酸塩の大きな違いは、硫酸塩が硫黄原子に酸素原子が4個結合したものであるのに対し、亜硫酸塩は硫黄原子に酸素原子が3個結合したものであることです。
サルフェートとは
硫酸塩は、硫黄原子を中心に4個の酸素原子が結合したアニオンです。
硫酸アニオンの電荷は-2であり、硫酸塩の分子式はSO4-2です。
硫酸陰イオンは硫酸の共役塩基です。
硫酸がイオンに解離すると硫酸アニオンとプロトン(H+)が与えられます。
硫黄原子と酸素原子の結合を考えると、2つの酸素原子は二重結合で、残りの2つの酸素原子は単結合で結合している。
これは、硫黄原子が最大6個の結合を周囲に持つことができるためです。
そのため、単結合で結合している酸素原子に2つの負の電荷が見られます。
硫黄原子の酸化状態は+6、酸素原子の酸化状態はそれぞれ-2ですが、実験的に求めると、硫黄原子と酸素原子の結合長は同じになります。
これは、共鳴と呼ばれる現象によるものだ。
硫黄原子と酸素原子の軌道が重なっているため、これらの原子の周りの電子は非局在化している。
したがって、硫黄原子と酸素原子の間の結合長は、S-O単結合とS=O二重結合の中間の長さとなる。
実際の結合長は149pmであることが分かっている。
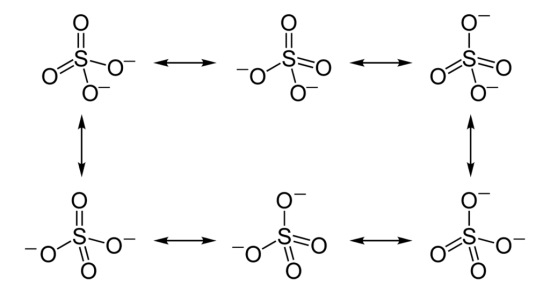 :図1 硫酸塩の共鳴現象
:図1 硫酸塩の共鳴現象
硫酸アニオンのモル質量は約96g/molです。
通常、硫酸アニオンは水に溶ける。
しかし、硫酸カルシウムのような化合物は水に難溶性です。
硫黄原子の周りの形状は四面体であり、硫黄原子の周りの結合は共鳴により同じであると考えられている。
亜硫酸アニオンは、硫黄原子が最も高い酸化状態にあるため、酸化を受けることができない。
一般的な硫酸塩の例
- バリウム(BaSO4)
- アングルサイト(PbSO4)
- 無水石(CaSO4)
- ジプサム(CaSO4.2H2O)
- エプソマイト (MgSO4.7H2O)
亜硫酸塩とは
亜硫酸塩は、硫黄原子と酸素原子からなる陰イオンです。
亜硫酸アニオンは、1個の硫黄原子が3個の酸素原子と結合しています。
亜硫酸アニオンの電荷は-2です。
亜硫酸アニオンでは、1つの酸素原子が二重結合で硫黄原子に結合し、他の2つの酸素原子は単結合で硫黄原子に結合しています。
しかし、硫黄原子の周りの結合長は同じで、S-O単結合とS=O二重結合の間の結合長の値になっています。
それは構造の共鳴によるものです。
したがって、すべての結合が同じであると考えられる。
図2:亜硫酸塩の共鳴構造
また、亜硫酸アニオンは硫黄原子に一対の電子を持つ。
亜硫酸アニオンのモル質量は約80g/molです。
亜硫酸塩の硫黄原子の周りの形状は、三角錐の形状をしている。
Na+、K+、NH4+の亜硫酸塩は水に溶ける。
しかし、他のほとんどの亜硫酸塩は水に溶けない。
亜硫酸塩の硫黄原子は+4酸化状態であり、+6酸化状態まで酸化できるため、亜硫酸塩は酸化反応を起こすことができる。
いくつかの一般的な亜硫酸塩の例
- 亜硫酸銅(CuSO3)
- 亜硫酸亜鉛(ZnSO3)
- 亜硫酸マグネシウム (MgSO3)
- 亜硫酸カリウム (K2SO3)
硫酸塩と亜硫酸塩の類似性
- どちらも負電荷を持つ陰イオンである
- アニオン全体の電荷は、どちらも-2です。
- 両者とも硫黄原子と、硫黄原子に結合した酸素原子からなる。
- 両アニオンとも化学構造上、共鳴を示す
- 両アニオンの酸素の酸化状態は-2です。
- 両者とも硫黄は還元反応を起こすことができる。
硫酸塩と亜硫酸塩の違いについて
定義
硫酸塩。
硫酸塩は、硫黄原子の周りに4つの酸素原子が結合したアニオンです。
亜硫酸塩 硫黄原子と酸素原子で構成される陰イオン。
モル質量
硫酸塩 硫酸塩のモル質量は約96g/molです。
亜硫酸塩。
亜硫酸塩のモル質量は約80g/molです。
溶解度
硫酸塩。
ほとんどの硫酸塩は水に溶ける。
亜硫酸塩 ほとんどの亜硫酸塩は、水に不溶です。
ジオメトリー
硫酸塩。
硫酸塩の硫黄原子周りの形状は正四面体です。
亜硫酸塩。
硫黄原子を中心とした形状が三角錐の亜硫酸塩。
硫黄の酸化状態
硫酸塩。
硫酸塩の硫黄の酸化状態は+6です。
亜硫酸塩。
亜硫酸塩の硫黄の酸化状態は+4です。
酸化反応
硫酸塩 硫酸塩は酸化反応を起こさない。
亜硫酸塩。
亜硫酸塩は酸化反応を起こすことができる。
結論
硫酸塩と亜硫酸塩には、いくつかの類似点および相違点があります。
しかし、どちらも実験室や産業界でよく使用される化学物質です。
硫酸塩と亜硫酸塩の主な違いは、硫酸塩が硫黄原子に4個の酸素原子が結合したものであるのに対し、亜硫酸塩は硫黄原子に3個の酸素原子が結合したものであることです。
