主な相違点 – 逆滴定法と直接滴定法
滴定は、与えられた混合物中に存在する未知の化合物の量を特定するために使用される化学技術です。
この手法では、既知の濃度の溶液を使用して、サンプルに存在する未知化合物の濃度を求めます。
しかし、未知化合物について知っていなければ、この同定に使用すべき既知濃度の溶液を決定することはできません。
滴定の終点は、未知化合物と既知化合物との反応の終了点を示します。
滴定は様々な方法で行うことができ、いくつかの種類があります。
逆滴定と直接滴定がその2種類です。
逆滴定と直接滴定の大きな違いは、逆滴定が濃度既知の化合物の残量を求めることで未知化合物の濃度を決定するのに対し、直接滴定は未知化合物の濃度を直接測定する点です。
裏面滴定とは
逆滴定とは、濃度既知の化合物の過剰量を用いて、未知化合物の濃度を求める滴定法です。
これらの化合物の間には化学反応があります。
濃度既知の化合物の添加量はすでに分かっているので、逆滴定を行えば、未知化合物と反応した化合物の量を求めることができます。
滴定には、滴定剤と滴定液の2つの成分が関与しています。
滴定液は濃度既知の溶液です。
滴定液は分析対象物または試料です。
この試料は濃度未知の化合物で構成されており、この化合物は滴定液と反応するはずです。
逆滴定は、滴定液と滴定剤とが直接反応することはありません。
まず、化学反応を起こす可能性のある化合物を試料溶液に過剰に添加します。
そして、残った化合物の量を測定します。
したがって、ここでの滴定剤も既知の化合物です。
例
この概念を理解するために、ある例を考えてみましょう。
濃度不明の金属イオンを含む金属イオン溶液が与えられたとします。
この溶液の分析には、一般的な滴定法であるEDTA逆滴定法が利用できます。
ここで、まず試料溶液に過剰量のEDTAを加えます。
EDTA溶液の濃度は、後で一次標準物質を用いて決定する必要があります。
EDTAを添加すると、金属イオン-EDTA複合体が形成される。
その後、EBT指示薬の存在下、Mg+2溶液を用いて試料中に存在するEDTAの残量を測定する。
金属イオンは常にEDTAと1:1の割合で錯体を形成しています。
先に添加したEDTAの量が分かっているので、未知の金属と反応したEDTAの量を計算することができます。
遊離のEBTは青色です。
金属イオンとEBTの複合体はワインレッドに発色する。
さらに、滴定の終点を決定するために逆滴定を用いることができます。
滴定の終点は、終点で急激に色が変化するため、簡単に終点を求めることができないことがあります。
そのような時に、逆滴定法を使って、滴定の終点を正確に求めることができるのです。
直接滴定とは
直接滴定とは、未知化合物と濃度既知の化合物を反応させる基本的な滴定方法です。
ここでは、逆滴定のような過剰な試薬の添加は行いません。
未知化合物を既知化合物と直接反応させます。
従って、滴定の終点は反応の終点を示します。
その終点を用いて、試料溶液中に存在する未知化合物の量を決定することができます。
直接滴定の終点は、その後の計算で直接利用されるため、慎重に求める必要があります。
しかし、直接滴定の終点は、正確な当量点ではないことが多いのです。
これは、滴定に使用した指示薬が変色したときが終点となるためです。
この色の変化は、反応が終了してしばらくしてから与えられます。
したがって、反応の終了点を正確に決めることは非常に重要です。
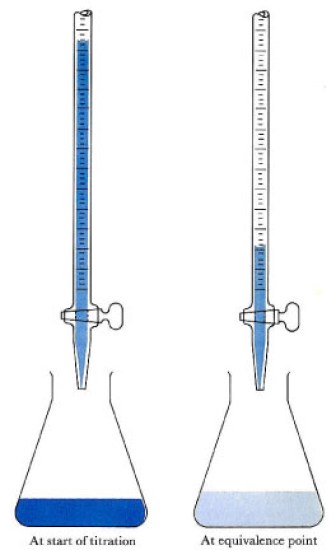 図2:直接滴定の終点は、溶液の色の変化から判断することができる。
図2:直接滴定の終点は、溶液の色の変化から判断することができる。
酸塩基滴定は、直接滴定の良い例です。
ここでは、酸と塩基を反応させる。
酸と塩基はほとんど無色の化合物なので、反応の終点を決定するために指示薬が使われます。
反応の進行に伴い、溶液のpHは変化する。
あるpHになると指示薬は色の変化を示す。
色が変化した時点を反応の終点とします。
そして、酸と塩基の化学量論的関係から、未知物質(酸または塩基)の濃度を決定することができる。
バック滴定と直接滴定の違い
定義
逆滴定(Back Titration)。
濃度が既知の化合物の過剰量を用いて未知化合物の濃度を決定する滴定方法。
直接滴定(Direct Titration)。
直接滴定とは、未知化合物と濃度既知の化合物を反応させる基本的な滴定方法です。
反応
逆滴定法。
逆滴定法では、2つの化学反応が起こる。
直接滴定法。
直接滴定法では、1つの化学反応が起こる。
滴定
逆滴定です。
逆滴定では、2つの既知の化合物の間で滴定を行う。
直接滴定。
既知の化合物と未知の化合物の間で滴定を行う。
ティトランド
逆滴定(Back Titration)。
逆滴定の滴定液は、過剰に添加した試薬の残量です。
直接滴定(Direct Titration)。
直接滴定の滴定液は、未知化合物です。
アプリケーション
逆滴定(Back Titration)。
逆滴定は、急激な色の変化がある場合に、正確な終点を決定するために使用します。
直接滴定。
直接滴定は、滴定の終点を容易に求めることができる場合に使用されます。
結論
滴定は、試料溶液中の未知化合物の同定や定量に非常に有用な化学的手法です。
滴定法には、背面滴定と直接滴定があります。
逆滴定と直接滴定の主な違いは、逆滴定が濃度既知の化合物の残量から未知化合物の濃度を求めるのに対して、直接滴定は未知化合物の濃度を直接測定することで、未知化合物の濃度を求めます。
