遺伝子発現とは、特定の遺伝子がコードする情報に基づいて、機能性タンパク質のポリペプチド鎖が合成されることである。
特定のタンパク質の合成量は、遺伝子の発現を調節することによって制御することができる。
タンパク質の合成の様々な段階において、遺伝子の発現を差配することが可能である。
しかし、真核生物と原核生物の遺伝子では、その発現制御が異なっている。
Lacオペロンは、大腸菌の乳糖代謝を担う遺伝子群です。
lacオペロンの発現制御は、培地中のラクトースとグルコースの濃度に応答して実現される。
分子生物学の入門書では、原核生物の遺伝子制御の代表例として、このlacオペロンの発現制御が用いられている。
遺伝子発現の制御とは?
遺伝子発現の制御とは、特定の遺伝子産物(タンパク質またはRNA)の産生を増加または減少させるために細胞が用いる広範なメカニズムを意味する。
これは、以下に述べるように、タンパク質合成の様々なステップで実現される。
- 複製レベル – DNA複製の際に生じる変異が、遺伝子発現の変化を引き起こす可能性があります。
- 転写レベル – 特定の遺伝子の転写は、リプレッサーとアクチベーターによって制御される。
- 転写後レベル – RNAスプライシングなどの転写後の修飾により、遺伝子の発現を実現する。
- 翻訳レベル – mRNA分子の翻訳は、RNA干渉経路などの様々なプロセスによって制御することができる。
- 翻訳後レベル – 翻訳後修飾を制御することにより、タンパク質の合成を翻訳後レベルで制御することができる。
しかし、原核生物における遺伝子発現の制御は、主に転写の開始時に達成される。
これには、遺伝子発現を正に制御するアクチベーターと、負に制御するリプレッサーが関与している。
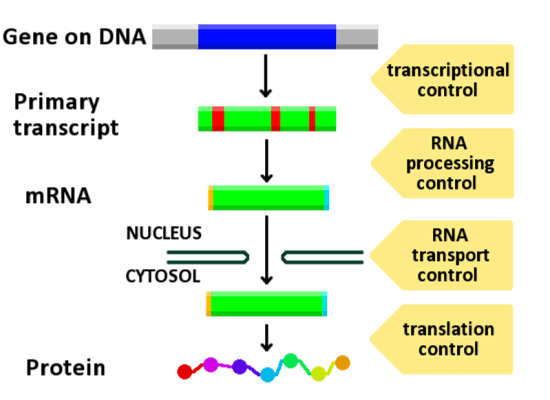
図1に、タンパク質合成の各段階における遺伝子発現の制御を示す。
図1: 遺伝子発現の制御機構
Lacオペロンとは
lacオペロンとは、大腸菌の乳糖代謝を担う遺伝子群のことである。
したがって、lacオペロンは、大腸菌ゲノムの機能単位です。
lacオペロンに含まれるすべての遺伝子は、単一のプロモーターによって制御されています。
したがって、オペロン内のすべての遺伝子は一緒に転写される。
この遺伝子の産物は、ラクトースを細胞のサイトゾルへ輸送し、ラクトースをグルコースへ消化する役割を担うタンパク質です。
グルコースは細胞呼吸で使われ、ATPの形でエネルギーが産生される。
lacオペロンは、他の多くの腸内細菌にも存在する可能性があります。
lacオペロンの構造を図2に示します。
図2: Lacオペロン
lacオペロンは、1つのプロモーターによって制御される3つの遺伝子から構成されている。
これらの遺伝子は、lacZ, lacY, lacAです。
これらの遺伝子は、それぞれβ-ガラクトシダーゼ、β-ガラクトシドパーミアーゼ、β-ガラクトシドトランスアセチラーゼと呼ばれる乳糖代謝に関わる3つの酵素をコードするものです。
β-ガラクトシダーゼは、乳糖をグルコースとガラクトースに分解する酵素です。
β-ガラクトシドペルミアーゼは、細胞膜に埋め込まれ、乳糖を細胞質内に輸送することが可能である。
β-ガラクトシドトランスアセチラーゼは、アセチルCo-Aからβ-ガラクトシドにアセチル基を転移するのに関与している。
lacオペロンの転写により、1つのmRNA分子から3つの遺伝子産物すべてを産生するポリシストロンmRNA分子が生成される。
一般に、ラクトースの異化にはlacZとlacYの遺伝子産物で十分です。
lacオペロンは、これら3つの遺伝子に加えて、様々なタンパク質が結合して転写を制御することができる多数の制御領域から構成されている。
lacオペロンの主要な制御配列は、プロモーター、オペレーター、カタボリック活性化タンパク質(CAP)結合部位です。
プロモーターは、遺伝子の転写を司る酵素であるRNAポリメラーゼの結合部位として機能する。
オペレーターは、lacリプレッサーが結合する負の制御部位として機能する。
CAP結合部位は、CAPが結合する正の制御部位として機能する。
Lacオペロンはどのように制御されているのか?
原核生物の遺伝子発現の制御は、誘導性オペロンによって行われる。
このオペロンには、異なる種類のタンパク質が結合し、細胞の要求に応じてオペロンの転写を活性化したり抑制したりする。
Lacオペロンは、誘導性オペロンの一つです。
Lacオペロンは、二糖類であるラクトースをグルコースに変換してエネルギー生産に利用し、グルコースが細胞内で利用できないときに、細胞呼吸で容易に利用できるようにするものです。
lacオペロンは、細胞内にグルコースがあるかないかで、「オフ」と「オン」の状態に制御されている。
lacリプレッサーはlacオペロンの「ターンオフ」モードを担当し、CAPはlacオペロンの「ターンオン」モードを担当する。
Lacリプレッサー
lac リプレッサーとは、グルコースの存在下で lac オペロンの転写を阻害するラクトースセンサーを指します。
細胞呼吸におけるグルコースの使用は、ラクトースと比較して、エネルギー生産においてより少ないステップしか必要としない。
したがって、グルコースが細胞内に存在すると、細胞内の経路で容易に分解され、エネルギーが生産される。
また、グルコースが呼吸に使われる場合、細胞呼吸の効率を最大にするためには、前者の目的でラクトースを使用することは避けなければならない。
このような状況において、lacオペロンのオペレーター領域にlacリプレッサーが結合することで、lacオペロンの転写を阻害することができる。
一般に、オペレーター領域はプロモーター領域と重なっている。
したがって、lacリプレッサーがオペレーター領域に結合すると、完全なプロモーター領域が利用できないため、RNAポリメラーゼはプロモーター領域に結合することができない。
細胞内でグルコースが容易に利用でき、ラクトースが利用できない場合、lacリプレッサーはオペレーター領域に強く結合し、lacオペロンの転写を阻害する。
lacオペロンの制御を図3に示す。
 :図3 Lacオペロンの制御機構
:図3 Lacオペロンの制御機構
カタボライト・アクティベーター・プロテイン(CAP)
CAPタンパク質は、lacオペロンの転写を活性化するグルコースリプレッサーを指します。
細胞がグルコースを使い果たし、ラクトースが細胞質内で容易に入手できるようになると、lacリプレッサーはDNAと結合する能力を失い、オペレーターから浮遊する。
そのため、リプレッサーはオペレーター領域から浮き上がり、プロモーター領域がRNAポリメラーゼとの結合に利用できるようになる。
ラクトースが利用可能になると、その分子の一部はラクトースの小さな異性体であるアロラクトースに変換される。
このアロラクトースがlacリプレッサーに結合することで、リプレッサーはオペレーター領域から緩められる。
したがって、アロラクトースは誘導剤として働き、lacオペロンの発現を誘発する。
さらに、lacオペロンも誘導性オペロンと考えられている。
しかし、RNAポリメラーゼだけでは、プロモーター領域に完全に結合することができない。
そこで、CAPはRNAポリメラーゼとプロモーターの緊密な結合を助ける。
プロモーターの上流にあるCAP結合部位に結合する。
CAPのDNAへの結合は、サイクリックAMP(cAMP)と呼ばれる低分子化合物によって制御されている。
cAMPは大腸菌がグルコース非存在下で作る飢餓シグナルとして機能する。
cAMPがCAPに結合すると、CAPの立体構造が変化し、CAPがlacオペロンのCAP結合部位に結合することが可能になる。
しかし、細胞内のグルコース濃度が非常に低いときには、cAMPが細胞内に存在する。
したがって、lacオペロンの活性化は、グルコースが細胞にとって利用可能でないときにのみ達成されうる。
結論として、lacオペロンの活性化は、細胞内でグルコースが利用できず、ラクトースが利用できるときに達成される。
グルコースとラクトースの両方が細胞内に存在しない場合、lacリプレッサーはlacオペロンに結合したまま、オペロンの転写を阻止するのです。
| — | — | — | — |
| グルコース|ラクトース|機構|制御|||。
結論
lacオペロンは、乳糖代謝に必要なタンパク質が遺伝子クラスターとして存在する誘導性オペロンである。
したがって、lacオペロンの転写によって、複数の遺伝子産物を合成することができるポリシストロンmRNA分子が生成される。
lacオペロンは、グルコースの非存在下と細胞呼吸のためにラクトースが細胞内に存在する場合にのみ発現される。
lacリプレッサーは、グルコースが容易に利用でき、ラクトースが利用できないときに、lacオペロンのオペレーター領域に結合する。
CAPは、グルコースが手に入らず、ラクトースが手に入りやすいときに、lacオペロンのオペレーターに結合して、転写を助ける。
そのため、細胞はラクトースを細胞呼吸に利用してエネルギーを生産することができるようになる。
