モル質量は物質の物理的性質の一つです。
密度、融点、沸点、系内で別の物質と反応する物質の量など、他の物理的・化学的性質の分析、比較、予測に非常に有用です。
モル質量を計算する方法は1つだけではありません。
直接法を用いる方法、化合物中の異なる元素の原子量を加算する方法、沸点上昇や凝固点降下を用いる方法などがあります。
この記事では、これらの主要な方法のいくつかを簡潔に説明する。
モル質量とは
モル質量とは、特定の物質の1モルの質量のことです。
物質のモル質量の単位としては、gmol-1が最も一般的に使われています。
しかし、モル質量のSI単位はkgmol-1(またはkg/mol)です。
モル質量は以下の式で計算できる。
モル質量=物質の質量(Kg)/物質の量(mol)
モルまたはモルは、物質の量を測定するために使用される単位です。
ある物質の1モルは、その物質が構成する原子(または分子)の6.023×1023個という非常に大きな数に相当する。
この数はアボガドロ数と呼ばれる。
原子の種類が何であれ、1モルはその量の原子(または分子)に等しいので、定数となります。
したがって、モル質量は新しい定義を与えることができます。
つまり、モル質量とは、ある特定の物質の6.023×1023個の原子(または分子)の総質量のことなのです。
混乱を避けるために、次の例を見てみましょう。
- 化合物AはAの分子で構成されている。
- 化合物 B は B の分子で構成されている。
- 化合物Aの1モルは、Aの分子6.023×1023個で構成されている。
- 化合物Bの1モルは、B分子の6.023×1023で構成されています。
- 化合物Aのモル質量は、6.023×1023個のA分子の質量の合計です。
- 化合物Bのモル質量は、6.023×1023個のB分子の質量の総和です。
さて、これを実際の物質に当てはめてみましょう。
1モルのH2Oは6.023×1023個のH2O分子で構成されています。
6.023 x 1023個のH2O分子の質量の合計は約18gであるから、H2Oのモル質量は18g/molです。
モル質量の求め方
物質のモル質量は、次のようないくつかの方法を用いて算出することができます。
- 原子量を用いる
- モル質量の計算式を用いる。
- 沸点標高から
- 凝固点降下から
- 浸透圧から
これらの方法について、以下に詳しく説明する。
原子質量の利用
分子のモル質量は、原子量を用いて決定することができる。
これは、存在する各原子のモル質量を足し合わせるだけでよい。
元素のモル質量は次のように表される。
元素のモル質量=相対原子質量×モル質量定数(g/mol)
相対原子質量とは、炭素12原子の質量に対する原子の質量のことであり、単位はない。
この関係は次のように与えることができる。
Aの分子量=A1分子の質量/[炭素12原子1個の質量×(1/12)]。
この手法を理解するために、次のような例を考えてみよう。
以下は、同一原子の化合物、異なる原子を複数組み合わせた化合物、多数の原子を組み合わせた化合物の計算です。
- H2のモル質量
o 存在する原子の種類 = H原子2個
o 相対的な原子質量 = 1.00794 (H)
o 各原子のモル質量 = 1.00794 g/mol (H)
o 化合物のモル質量 = (2 x 1.00794) g/mol
= 2.01588 g/mol
- HClのモル質量
o 存在する原子の種類 = H原子1個とCl原子1個
o 相対的な原子質量 = 1.00794 (H) + 35.453 (Cl)
o 各原子のモル質量 = 1.00794 g/mol (H) + 35.453 g/mol (Cl)
o 化合物のモル質量 = (1 x 1.00794) + (1 x 35.453) g/mol
= 36.46094 g/mol
- C6H12O6 のモル質量
o 存在する原子の種類 = C原子6個、H原子12個、O Cl原子6個
o 相対的な原子質量 = 12.0107 (C) + 1.00794 (H) + 15.999 (O)
o 各原子のモル質量 = 12.0107 g/mol + 1.00794 g/mol (H) + 15.999 g/mol (O)
o 化合物のモル質量 = (6 x 12.0107) + (12 x 1.00794) + (6 x 15.999) g/mol
= 180.15348 g/mol
U
沸点上昇から
沸点上昇とは、純溶媒にある化合物を加えると、その混合物の沸点が純溶媒の沸点より高くなることを表す現象です。
したがって、2つの沸点の温度差から、その添加化合物のモル質量を求めることができる。
純溶媒の沸点をTsolvent、溶液(添加化合物あり)の沸点をTsolutionとすると、2つの沸点の差は以下のように与えることができる。
ΔT = 溶液 – 溶媒
クラウジウス・クラペイロンの関係やラウールの法則を用いると、ΔTと溶液のモラリティの関係が得られます。
ΔT = Kb . M
ここで、Kbはエブリロスコピック定数で溶媒の性質にのみ依存し、Mはモラリティです。
上の式から、溶液のモラリティの値を求めることができる。
この溶液の調製に使用した溶媒の量がわかっているので、添加した化合物のモル数の値を求めることができる。
モラリティ=添加した化合物のモル数(mol)/使用した純溶媒の質量(kg)
溶液中の化合物のモル数と添加した化合物の質量がわかったので、化合物のモル質量を求めることができます。
モル質量=化合物の質量(g)/化合物のモル数(mol)
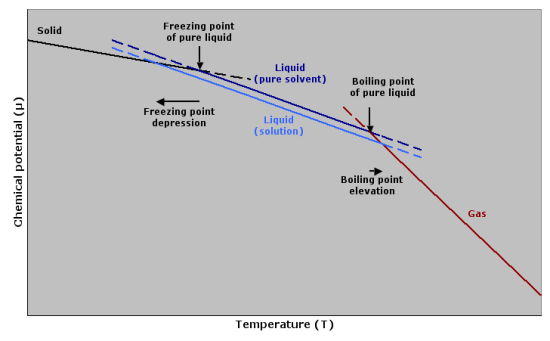 図01:沸点上昇と凝固点降下
図01:沸点上昇と凝固点降下
凍結点降下から
凝固点降下は沸点上昇の逆です。
ある化合物を溶媒に加えたとき、その溶液の凝固点が純溶媒のそれよりも低くなることがあります。
そのとき、上の式は少し修正される。
ΔT = 溶液 – 溶媒
沸点が初期値より低くなったので、ΔTの値はマイナスとなる。
溶液のモラリティは沸点上昇法と同じように求めることができる。
ΔT = Kf . M
ここで、Kfはクライオスコピック定数と呼ばれるものです。
溶媒の性質にのみ依存する。
それ以外の計算は沸点上昇法と同じです。
ここで、添加した化合物のモル数も以下の式で計算することができる。
モル%=化合物のモル数(mol)/使用した溶媒の質量(kg)
次に、添加した化合物のモル数と添加した化合物の質量から、モル質量を算出することができます。
モル質量=化合物の質量(g)/化合物のモル数(mol)
浸透圧より
浸透圧とは、ある溶液に純粋な溶媒を浸透させないために必要な圧力のことです。
浸透圧は次の式で与えられる。
浸透圧 ∏ = MRT
ここで、∏は浸透圧です。
溶液のモル比は次の式で与えられる。
モル比=化合物のモル数(mol)/溶液の体積(L)
溶液の体積を測定し、上記のようにモル比を計算することができる。
したがって、溶液中の化合物のモル数を測定することができる。
そうすると、モル質量を求めることができる。
モル質量=化合物の質量(g)/化合物のモル数(mol)
物質のモル質量を知ることの重要性とは
- 異なる化合物のモル質量は、それらの化合物の融点と沸点を比較するために使用することができます。
- モル質量は、化合物に存在する原子の質量パーセントを決定するために使用されます。
- モル質量は、化学反応において、反応した特定の反応物の量を知るため、または得られる生成物の量を知るために非常に重要です。
- モル質量を知っておくことは、実験装置を設計する前に非常に重要です。
概要
ある化合物のモル質量を計算する方法はいくつかある。
その中で最も簡単な方法は、その化合物に含まれる元素のモル質量を足し合わせることである。
