主な相違点 – 電気化学セルと電解セルの比較
電気化学は、化学反応が起こる系での電子の動きを研究する学問です。
ここでは、化学反応を利用して電流を発生させることも、電流を利用して非自発的な化学反応を起こしやすくすることもできる。
どちらの方法でも、電気エネルギーから化学エネルギーへの変換、またはその逆の変換が行われることになる。
これらの変換が行われるシステムは、細胞として知られており、より正確には電気化学セルと呼ばれる。
電気化学セルには、ボルタ電池と電解槽と呼ばれる2つのタイプがあります。
電気化学セルと電解セルの主な違いは、電気化学セルが動作に外部電流を必要としないのに対し、電解セルは動作に外部電流を必要とする点である。
電気化学セルとは?
電気化学電池は、自発的な化学反応によって電気エネルギーを生み出すことができるシステムです。
その化学反応を酸化還元反応という。
酸化還元反応は、化学種間で電子が移動することによって起こる。
酸化還元反応には、酸化反応と還元反応という2つの半反応があります。
酸化反応は常に系に電子を放出し、還元反応は系から電子を奪う。
したがって、この2つの半反応は同時に起こる。
電気化学セルには、ガルバニックセルと電解セルの2種類があります。
電気化学セルは、2つの半電池から構成されている。
2つのハーフセルで半反応が起こる。
そのセルで起こる化学反応により、2つのハーフセルの間に電位差が蓄積される。
ハーフセルは、電極と電解質で構成されているはずです。
したがって、完全な電気化学セルは、2つの電極と2つの電解質で構成されます。
時には、2つのハーフセルが同じ電解質を使用することもあります。
もし、異なる2つの電解質が使用されている場合は、電解質間の接触を保つために塩橋を使用する必要がある。
これは,塩橋を介したイオンの移動のための通路を作ることによって行われる。
電子は、外部回路を通して半分のセルからもう一つのセルに流れます。
この2つの電極を陽極と陰極と呼びます。
酸化反応と還元反応は2つの電極で別々に起こります。
酸化反応は陽極で起こり、還元反応は陰極で起こります。
したがって、電子は陽極で生成され、外部回路を通じて陽極から陰極に移動します。
塩橋は、電荷をバランスさせるためにイオンを移動させ、系を中性(電気的)に保つのに役立ちます。
次のような電気化学セルを考えてみよう。
ここでは、陽極をZn(亜鉛)電極、陰極をCu(銅)電極とする。
酸化反応はZn電極で起こる。
そこでは、金属ZnがZn+2イオンに酸化される。
放出された電子は、外部ワイヤーを通過する。
生成されたZn+2イオンは溶液中に放出されます。
したがって、Zn電極は時間とともに溶解していきます。
還元反応は陰極付近で起こります。
カソードはCu電極です。
そこでは、外部回路から来た電子が溶液中のCu2+イオンに取り込まれ、Cu金属に還元される。
したがって、Cu電極の質量は時間とともに増加することになる。
外部配線を介した電子の流れは、酸化還元反応から生じる電流として測定することができる。
これが電気化学電池の典型的な構造です。
反応
- 陽極での反応(酸化)
Zn(s) → Zn+2(aq) + 2e
- 陰極での反応(還元)
Cu+2(aq) + 2e → Cu(s)
電解槽とは?
電解槽とは、電気化学電池の一種で、電気エネルギーを使って化学反応を起こさせることができる。
つまり、外部から電気エネルギーを供給する必要がある。
そうすれば、非自発的な反応を起こすことができる。
電解槽は、化合物の電気分解に最もよく使われる。
電解槽も固体金属を電極として構成されている。
外部回路に接続された2つの電極があります。
一方の電極は陽極として働き、もう一方の電極は陰極として働きます。
陽極では酸化反応が起こり、陰極では還元反応が起こる。
外部からの電気エネルギー供給(2つの電極に接続されたバッテリーから)により、カソードを介して電子の流れが発生します。
そして、この電子は電解液に入ります。
すると、溶液中の陽イオンが陰極の周りに集まり、陰極から流れてきた電子を獲得する。
したがって、これらの陽イオンは陰極で還元される。
陰極の電子は、溶液中の陰イオンをはじく。
これらの陰イオンは陽極に向かって移動する。
そこで、これらの陰イオンは電子を放出し、酸化される。
したがって、陽極は正の電荷を持ち、陰極は負の電荷を持つことになります。
次の例で考えてみよう。
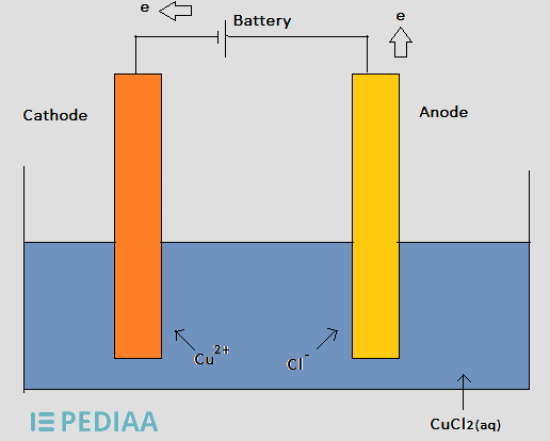 図2:塩化銅水溶液の電気分解
図2:塩化銅水溶液の電気分解
上記の電解槽では、電池から陰極に電子が供給され、Cu+2イオンが陰極の周りに集まり、陰極から電子を奪います。
そして、Cu+2イオンは還元されてCu金属となり、正極に析出する。
すると、Cl-イオンが陽極に向かって移動し、持っている余分な電子を放出する。
そこでCl-が酸化され、Cl2(g)が生成される。
反応
- 陽極での反応(酸化)
2Cl-(aq) → Cl2(g) + 2e
- 陰極での反応(還元)
Cu+2(aq) + 2e → Cu(s)
電気化学セルと電解セルの違い
定義
電気化学セル:電気化学セルは、自発的な化学反応によって電気エネルギーを生成することができるシステムです。
電解槽:電気化学槽の一種で、電気エネルギーを使って化学反応を起こすことができる槽。
エネルギー変換
電気化学電池:化学エネルギーが電気エネルギーに変換される。
電解槽:電気エネルギーが化学エネルギーに変換される。
外部電流
電気化学セル:電気化学セルは、外部からの電気エネルギー源を必要としない。
電解槽:電解槽は外部からの電気エネルギー源を必要とする。
化学反応
電気化学セル:電気化学セルでは、自然発生的な化学反応が行われる。
電解槽:電解槽では、非自発的な化学反応が起こる。
電極
電気化学セル:陽極がマイナスで陰極がプラス。
電解槽:陽極がプラス、陰極がマイナス。
電子の動き
電気化学セル:陽極から陰極へ電子を流す。
電解槽:電池から正極に電子が渡され、電解液を介して負極に電子が入る電解槽。
結論
電解槽は電気化学電池の一種です。
したがって、電解槽は一般的な電気化学セルが持つすべての構成要素で構成されている。
電気化学セルも電解セルも、電子が系内を循環している。
しかし、電気化学セルでは自発的な化学反応が起こるのに対して、電解セルでは非自発的な化学反応が起こる。
これが電気化学電池と電解槽の違いです。
