主な違い – 核電荷 vs 有効核電荷
核電荷と有効核電荷は、原子の特性を説明するために使用される 2 つの異なる化学用語です。
原子は、すべての物質が構成する最小の単位です。
原子は原子核と電子から構成されています。
原子核は、陽子と中性子で構成されています。
陽子は正の電荷を持つ素粒子です。
この陽子によって原子の核電荷が決定されます。
電子は原子核の周りを絶えず移動しています。
電子が移動する経路は、電子殻と呼ばれています。
一番外側の電子殻には、原子核に対する引力が最小になるように電子が配置されています。
これらの電子が経験する原子核の引力は、内殻電子からの反発と原子核の電荷に依存します。
外殻電子が受ける正味の電荷は有効核電荷と呼ばれる。
核電荷と実効核電荷の大きな違いは、実効核電荷の値は常に核電荷の値より低いということです。
核電荷とは
核電荷とは、原子核が持つ全電荷のことです。
基本的には正の電荷です。
これは、原子の原子核が陽子で構成され、陽子が正の電荷を持つ素粒子であるためです。
すべての原子は、原子核の中に少なくとも1個の陽子で構成されています。
したがって、原子核の電荷は常に正電荷です。
原子核は陽子と中性子で構成されている(プロチウム同位体を除く)。
陽子はプラスに帯電し、中性子は中性に帯電した素粒子です。
陽子1個の電荷は+1です。
陽子の数は元素の周期表全体で増加する。
したがって、核電荷もそれに応じて増加する。
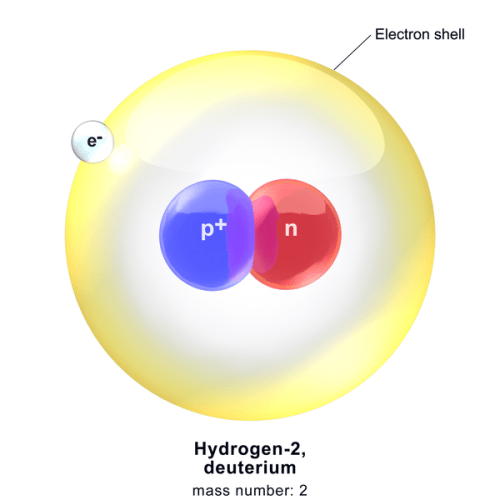 図1: 重水素原子は原子核に陽子1個と中性子1個からなる。
図1: 重水素原子は原子核に陽子1個と中性子1個からなる。
この陽子1個が重水素の核電荷に寄与している。
核電荷は、原子核と電子が引き合う大きな理由です。
核電荷が正であるため、負に帯電した電子は静電気力により原子核に引き寄せられる。
中性原子では、陽子と電子の数は等しい。
つまり、電子が核電荷を中和しているのです。
さらに、元素の核電荷は固定値です。
つまり、元素に同位体があっても、同位体の原子核に含まれる陽子の数は同じなので、それらの同位体の核電荷はすべて同じになります。
実効核電荷とは
有効核電荷とは、複数の電子を持つ原子において、電子が受ける正味の電荷のことです。
外殻電子とは、原子核から最も遠いところにある電子のことです。
この電子は、原子核との距離が遠いため、原子核に対する引力が最も小さい。
そのため、この外殻電子は原子核からの影響を最小限にとどめることができます。
最外殻にある電子は価電子と呼ばれます。
複数の電子を持つ原子では、電子-原子核引力とは別に、電子-電子反発力が存在する。
電子が受ける正味の電荷や有効核電荷は、次の式で計算できる。
有効核電荷の式
Zeff = Z – S
ここで、Zeff は有効核電荷です。
Zは原子番号(原子核に含まれる陽子の数)
S は遮蔽電子の数です。
遮蔽電子とは、原子核と外殻電子の間に位置する電子のことである。
上式は、原子核の引力から内殻電子の反発を差し引いた正味の電荷を表している。
核電荷と実効核電荷の違い
定義
核電荷。
核電荷とは、原子核の全電荷のこと。
有効核電荷。
外殻電子が原子で経験する正味の電荷。
電子
核電荷。
核電荷は、原子中の電子の電荷に依存しない。
実効的な核電荷。
有効核電荷:内周電子の影響と核電荷を考慮して計算する。
プロトン
核電荷。
核電荷:原子核に存在する陽子の数のみに依存する。
実効的な核電荷。
有効核電荷は、陽子の数だけには依存しない。
値
核電荷。
核電荷の値は常に正の値であり、有効核電荷の値よりも大きい。
有効核電荷。
有効核電荷は、核電荷の値よりも低い値です。
結論
核電荷と実効核電荷は、化学元素の原子について計算される2つの異なる値です。
核電荷とは、原子核の全電荷のことです。
有効核電荷は、最外殻電子が受ける正味の電荷です。
核電荷と実効核電荷の大きな違いは、実効核電荷の値が常に核電荷の値より低いことです。
