主な違い – VSEPR vs 価電子結合理論
VSEPR説と価電子結合説は、化学の分野で共有結合化合物の性質を説明するために用いられる2つの理論です。
VSEPR説は、分子内の原子の空間配置を説明する理論です。
この理論では、孤立電子対と結合電子対の反発を利用して、ある分子の形状を予測する。
価電子結合説は、原子間の化学結合を説明する理論です。
この理論では、軌道の重なりによってシグマ結合とπ結合のどちらかが形成されると説明する。
VSEPRと価電子結合理論の主な違いは、VSEPRが分子の形状を記述するのに対し、価電子結合理論は分子内の化学結合を記述する点です。
VSEPR理論とは?
VSEPR(Valence Shell Electron Pair Repulsion)理論とは、分子の形状を予測する理論です。
VSEPR理論を用いると、共有結合や配位結合を持つ分子の空間配置を提案することができる。
この理論は、原子の価電子帯にある電子対の反発を利用したものです。
電子対には、ボンドペアとローンペアの2種類があります。
これらの電子対の間には、3種類の斥力が存在する。
- ボンドペア-ボンドペア反発
- ボンドペア – ローンペア反発
- ローンペア – ローンペア反発
これらの反発は、これらのペアがすべて電子対であるために起こります。
これらのペアはすべて負に帯電しているので、互いに反発し合います。
ここで重要なのは、これらの反発は等しくないということです。
ローン・ペアの反発はボンド・ペアの反発より大きいのです。
つまり、ローンペアはボンドペアよりも大きな空間を必要とするのです。
- ローンペアによる反発 > ボンドペアによる反発
VSEPR理論は、電子の形状と分子の形状の両方を予測することができます。
電子の形状とは、分子の形状であり、孤立対が存在することも含まれる。
分子形状は、結合電子対のみを考慮した分子の形状です。
VSEPR理論で得られる分子の基本的な形状は以下の通りです。
図1: 分子形状の一覧表
分子の形状は、中心原子を中心とした結合電子対と孤立電子対の数で決定される。
中心原子は、分子内に存在する他の原子の中で最も電気陰性度の低い原子であることが多い。
しかし、中心原子を決定する最も正確な方法は、各原子の相対的な電気陰性度を計算することである。
2つの例を見てみよう。
- BeCl2 (塩化ベリリウム)
中心原子はBeです。
価電子を2個持っています。
Cl原子は1原子につき1個の電子を共有できる。
したがって、中心原子のまわりの電子の総数=2(Beから)+1×2(cl原子から)=4
したがって、Be原子のまわりの電子対の数 = 4 / 2 = 2
存在する単結合の数 = 2
存在する孤立対の数 = 2 – 2 = 0
よって、BeCl2分子の形状は直線です。
図2: BeCl2分子の線型構造
- H2O分子
中心原子はOです。
Oの周りの価電子の数は6個。
Hが1原子あたり共有する電子の数は1個。
したがって、Oのまわりの電子の総数=6(O)+1×2(H)=8
Oの周りに存在する電子対の数 = 8 / 2 = 4
Oの周囲に存在する孤立対の数 = 2
Oの周りに存在する単結合の数 = 2
したがって、H2Oの幾何学的形状は角型です。
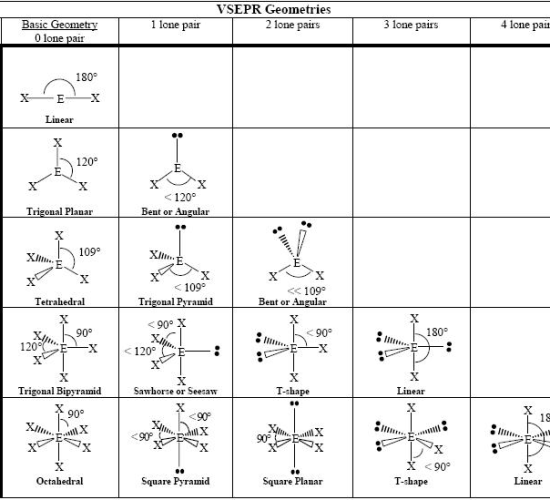 図3:H2O分子の形状
図3:H2O分子の形状
上の2つの例を見ると、どちらの分子も3つの原子から構成されている。
価電子結合理論とは
価電子結合理論とは、共有結合化合物における化学結合を説明する理論です。
共有結合化合物は、共有結合によって互いに結合している原子から構成されている。
共有結合は、2つの原子が電子を共有することによって形成される化学結合の一種である。
これらの原子は、軌道を埋めて安定させるために電子を共有する。
原子の中に不対電子があると、対になった電子を持つ原子に比べて安定性が低くなる。
そのため、原子はすべての電子を対にするために共有結合を形成しています。
原子は電子を殻の中に持っています。
この殻は、s殻、p殻、d殻などの副殻で構成されています。
s殻以外の殻は、軌道で構成されています。
各殻に含まれる軌道の数は次のとおりです。
| サブシェル|軌道数|軌道の名前 | ||
| s | 0 | – |
| p|3|px、py、pz||。 | ||
| d|5|dxz、dxy、dyz、dx2y2、dz2|。 |
各軌道は、反対のスピンを持つ電子を最大2個まで保持することができる。
価電子結合理論では、電子の共有は軌道の重なりによって行われる。
電子は原子核に引き寄せられるため、完全に原子から離れることはできない。
したがって、これらの電子は2つの原子の間で共有される。
共有結合には、シグマ結合とπ結合の2種類があります。
これらの結合は、軌道の重なりや混成によって形成される。
この混成の後、2つの原子の間に新しい軌道が形成される。
この新しい軌道は、混成の種類によって名前が付けられています。
シグマ結合は2つのs軌道の重なりによって常に形成されます。
p軌道が2つ重なるとπ結合が形成されます。
しかし、s軌道がp軌道に重なる場合は、s-s軌道の重なりとも、p-p軌道の重なりとも異なる。
このような結合を説明するために、科学者ライナス・ポーリングによって軌道の混成が発見された。
ハイブリッド化により、ハイブリッド軌道が形成される。
ハイブリッド軌道には、大きく分けて次の3種類があります。
sp3 ハイブリッド軌道
S軌道と3つのP軌道が混成してできる軌道。
(S軌道は球状、P軌道はダンベル状。
sp3軌道は新たな形状を得る)。
したがって、この原子は4つのハイブリッド軌道を持つことになります。
sp2 ハイブリッド軌道
s軌道とp軌道が2つ混成してできる軌道。
s軌道やp軌道とは形状が異なる。
原子は3つのハイブリッド軌道と、ハイブリッドしていないp軌道を持つようになる。
sp ハイブリッドオービタル
s軌道とp軌道が混成してできる軌道。
s軌道やp軌道とは形状が異なる。
この原子は2つのハイブリッド軌道と2つのハイブリッドでないp軌道を持つ。
VSEPRと価電子帯理論の違い
定義
VSEPR。
VSEPR理論とは、分子の形状を予測する理論です。
価電子結合理論。
価電子結合理論とは、共有結合化合物の化学結合を説明する理論。
基本情報
VSEPR VSEPRは、孤立電子対と結合電子対の反発を利用した理論です。
価電子結合理論。
価電子結合理論は、化学結合を形成するために軌道が重なり合うことに基づいている。
軌道
VSEPR VSEPR理論では、分子内の原子に存在する軌道の詳細は分からない。
価電子結合理論。
価電子結合理論では、分子の原子に存在する軌道の詳細がわかる。
ジオメトリー
VSEPR VSEPR理論により、分子の幾何学的な形状が与えられる。
価電子結合理論。
価電子結合論は分子の形状を与えない。
化学結合
VSEPR VSEPR理論では、原子間に存在する結合の種類は示されていない。
価電子結合理論。
原子間に存在する結合の種類を示す。
結論
VSEPR 理論と価電子結合理論は、いずれも化学種の形と結合を理解する ために開発された基礎理論です。
これらの理論は、共有結合を持つ化合物に適用される。
VSEPR 理論と価電子結合理論の違いは、VSEPR 理論が分子の形 を説明するのに対し、価電子結合理論は分子の原子間の化学結合の生成 を説明する点です。
