主な違い – アウフバウ原理 vs フントの法則
原子構造の発展は、ダルトンの近代原子論から始まった。
それは、すべての物質は原子でできており、原子はそれ以上小さな粒子に分割することはできないとした。
しかし、その後、J.J.トンプソンによる電子の発見、ラザフォードによる原子核の発見、ニールス・ボーアによる電子軌道の概念を経て、原子はさらに素粒子に分割できることが判明した。
現在受け入れられている原子の構造には、電子の殻、副殻、軌道の詳細が含まれている。
これらの殻や軌道への電子の入り方は、アウフバウの原理とフントの法則で記述することができる。
アウフバウ原理とフント則の大きな違いは、アウフバウ原理が副殻に電子を充填する順序を示すのに対し、フント則は副殻の軌道に電子を充填する順序を示す点です。
アウフバウ・プリンシプルとは?
アウフバウの原理とは、原子の副殻に電子が充填される順序は、エネルギー準位の低いものから高いものへと起こるというものです。
つまり、原子の軌道に電子が充填されるとき、電子はまずエネルギー準位の低い軌道を充填してから、エネルギー準位の高い軌道を充填する。
一般に、エネルギーは、殻準位では1<2<3<4の順で、軌道準位ではs<p<d<fの順で増加する。
例えば、第2殻のs、p、d、f軌道は第3殻のそれよりも常に低いエネルギーを持つはずです。
しかし、アウフバウの原理により、例外的にこれらの軌道に電子が充填されることがあります。
例えば、4s軌道は3d軌道よりもエネルギーが低いのですが、3殻が4殻よりも優先されることがあります。
このように、電子が軌道に充填される順序は、期待される順序とは異なっている。
期待される順序
1s < 2s < 3s < 3p < 3d < 4s < 4p < 4d < 5s…
実際の順序
1s < 2s < 3s < 3p < 4s < 3d < 4p < 5s < 4d…
しかし、各軌道のエネルギー準位を1つずつ覚えていくのは大変です。
そこで、以下の図を使って、簡単にエネルギー準位を決定することができます。
上の図は、エネルギー準位を決定するための図です。
ここでは、矢印の経路をたどることで、軌道の順序を求めることができる。
各矢印の頭の後、次の矢印から始める。
このようにすると、簡単にエネルギー準位を求めることができます。
フントの法則とは
フント則は、サブシェルの軌道に電子が充填される順序を説明するものです。
サブシェルは軌道の集合体です。
1つの副殻に存在する軌道の数は、副殻ごとに異なる。
例えば、sサブシェルはs軌道が1つだけ、pサブシェルはp軌道が3つ、dサブシェルはd軌道が5つで構成されています。
したがって、これらの軌道に電子を充填する順番があるはずです。
そうでないと、これらの原子は不安定になる。
1つの軌道には最大2個の電子を入れることができる。
フント則によれば、同じ副殻にあるすべての軌道は、まず電子が単独で占められ、その後に対になる。
つまり、電子はまず不対電子として満たされ、その後結合する。
したがって、電子を軌道に割り当てる際には、この法則に従います。
なぜなら、同じ副殻に電子対を持つ軌道と空の軌道があると、電子は負に帯電しており、同じ軌道にいると互いに反発し合うので、不安定な配置となるからです。
そのため、電子同士の反発が最小になるように電子を並べる傾向があります。
図2:軌道を占有する電子たち
さらに、この法則は、電子の “スピン “に合わせて電子が軌道に充填されることを説明する。
つまり、同じ副殻の単座軌道にある電子は、同じスピンを持っています。
この電子が対になると、電子同士の反発を抑えるために、2つの電子のスピンが反対になる。
電子対の一方の電子は “スピンアップ”、他方の電子は “スピンダウン “する。
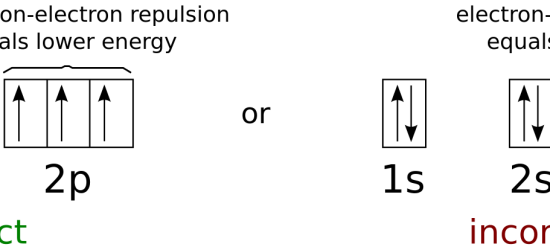 図3: 軌道の中の電子のスピン
図3: 軌道の中の電子のスピン
軌道が1つの場合、その電子は “スピンアップ “と “スピンダウン “のどちらかになる。
しかし、その電子が対になっている場合、もう一方の電子はこの電子と逆のスピンを持っているはずだ。
そうすることで、反発を最小限に抑えることができる。
アウフバウの原理とフント・ルールの類似性
- アウフバウ原理とフント則は、いずれも原子のエネルギー準位が電子で満たされる順番を示すものです。
アウフバウ原理とフント則の相違点
定義
アウフバウの原理。
アウフバウの原理は、原子の副殻が電子で満たされる順序を説明する。
フント則: フント則は、副殻の軌道に電子が充填される順序を説明する。
理論編
アウフバウ原理。
アウフバウの原理により、エネルギーレベルの低いものから高いものへとサブシェルが充填される。
フント則。
フント則によれば、軌道はまず電子が単独で占有し、次に電子のスピンに応じて対になる。
エネルギーレベル
アウフバウの原理 アウフバウの原理:電子が部分殻を満たす方法を説明する。
フント則:電子が部分殻の軌道を満たす方法を記述したもの。
反発
アウフバウの原理 アウフバウの原理は、電子間の反発を最小にすることを記述していない。
フント則:電子間の反発を最小にするように電子を充填する方法を示す。
結論
アウフバウの法則とフントの法則は、いずれも特定の原子の原子構造を解明する上で非常に重要なものです。
ある原子の電子の数がわかっていれば、上記の理論を用いて、その原子の電子の配置パターンを決定することができる。
アウフバウの法則とフントの法則の大きな違いは、アウフバウの法則が副殻に電子を充填する順序を示すのに対し、フントの法則は副殻の軌道に電子が充填される方法を示すことである。
