主な違い – オスモル濃度 vs トニシティ
浸透圧と張力は互いに密接な関係があります。
これらは、溶液の濃度の概念と、それらが浸透圧にどのように影響を与えるかを指しています。
しかし、その効果の表し方は互いに異なっている。
どちらの用語も、溶液が浸透性の膜で分離され、浸透圧が生じる状況に関連している。
浸透圧は溶液中に存在するすべての分子を考慮して総合的に作用するのに対し、張力は溶液中の非浸透性溶質分子の濃度のみを考慮します。
したがって、強壮剤は外部環境の指標であるのに対し、浸透圧は与えられた溶液そのものに関係すると言えます。
これが浸透圧と張力の大きな違いです。
オスモラリティとは
オスモル濃度とは、モル濃度と呼ばれる溶液中のモル数ではなく、溶液中に存在するオスモル数で溶液の濃度を表現する方法です。
したがって、モル比のような単位mol/Lの代わりに、オスモル比は1リットルあたりの溶質のオスモル数またはオスモル/Lという単位を使用します。
多くの場合、浸透圧はモル比と同じような値ですが、水溶性化合物の場合、浸透圧は溶液のモル比より大きくなります。
これは、浸透圧が溶質の総量であるのに対し、モル比は化合物全体の濃度であるためです。
例えば、水に溶けたNaClは、Na+とCl-というイオンに分離する。
例えば、NaClが水に溶けたとき、最初は2mol/Lであったとすると、モル比は2mol/Lのままですが、溶液中の溶質の総数が分離したイオンに考慮されて、浸透圧は4osmol/Lに増加します。
(2オスモル/LのNa+と2オスモル/LのCl-)。
周囲の環境の特性によって、ある溶液の浸透圧は3つの異なる形態をとることができる。
等浸透圧、高浸透圧、低浸透圧です。
与えられた溶液の浸透圧がその周囲と等しい場合、それは等浸透圧溶液と呼ばれます。
浸透圧が周囲より高い溶液を高浸透圧溶液といいます。
同様に、浸透圧が周囲より低い溶液は低浸透圧と呼ばれます。
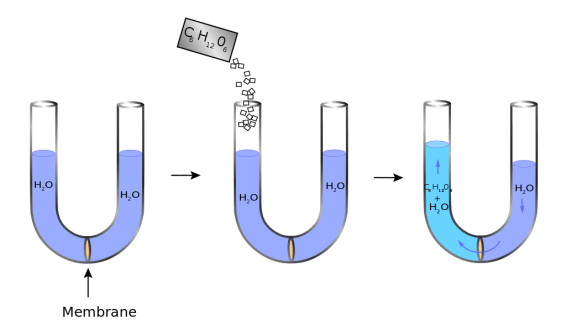
トニシティとは
浸透圧とは異なり、張力は膜を通過しない溶質の影響を受ける。
したがって、浸透圧勾配の指標であり、浸透圧そのものではない。
強壮度の概念は、異なる強さの濃度に浸された細胞の反応や挙動を説明するのに役立つ。
もし細胞が等張溶液中に置かれた場合、溶液の濃度は細胞内容物の濃度と同様です。
したがって、半透膜を通して溶媒分子の流入や流出が起こることはない。
しかし、細胞を高張の溶液に入れると、溶液の濃度が細胞の内容物の濃度よりも高くなる。
そのため、溶媒分子(この場合は水)は、膜の両側の濃度が同じになるまで細胞の外に流れ出し、膜が収縮します。
同様に、低張力溶液に細胞を入れると、溶液の濃度が細胞内容物の濃度より低いため、細胞内に水分が流入し、細胞は膨張し、最終的には破裂します。
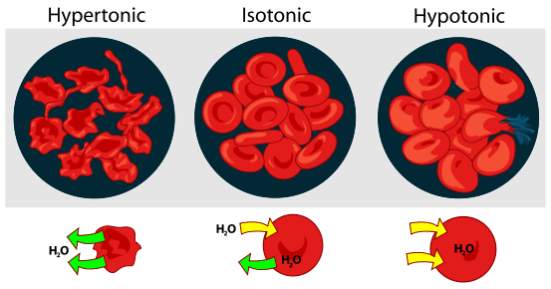 :異なる溶液が血球に与える影響
:異なる溶液が血球に与える影響
オスモラルとトニックの違い
定義
浸透圧は、与えられた溶液の浸透圧の尺度です。
Tonicityは、浸透膜で隔てられた2つの溶液間の浸透圧勾配の尺度です。
測定単位
Osmolarityはosmol/Lで測定される。
Tonicityは濃度測定に関連し、mol/Lで表される。
濃縮の定義
浸透圧は、膜を透過する溶質と透過しない溶質の合計数を考慮する。
Tonicityは、非浸透性溶質に関する濃度を考慮する。
周囲への影響
オスモル濃度とは、ある溶液の分析値を表すことが多い。
“血球の浸透圧の図” by LadyofHats. (パブリックドメイン) via Commons
“Osmosis diagram” by KDS4444 – Own work. (CC0) via コモンズ
保存する
