定量的またはリアルタイムPCRは、異なる実験条件下での遺伝子発現の相対的変化をモニタリングするためのルーチンアッセイとして使用されています。
QPCRにおけるプライマーおよびプローブの設計は、アッセイの品質と成功に影響を与える最も重要な要因の1つです。
QPCRのプライマー設計には、いくつかのガイドラインが適用されます。
プライマーのGC含量は35-65%、融点は60-68℃、二次構造、3塩基以上のGsやCsの繰り返し、プライマーダイマーの形成は避けるべきとされる。
QPCRとは
QPCRはPCRの一種で、リアルタイムに産物を定量することができる。
PCR産物を各ステップで標識することで、定量に蛍光色素を使用することができる。
QPCRアッセイでは2つの蛍光標識の方法を用いることができる。
それらは蛍光色素の使用と蛍光標識されたプローブの使用です。
蛍光色素は PCR 産物に結合し、プローブは PCR 産物とアニーリングして安定な三重鎖 DNA を形成する。
QPCCR で広く使われている蛍光色素は SYBR Green であり、プローブは Taqman です。
QPCR中のPCR産物の検出にプローブを使用することで、より正確な結果が得られ、アッセイの感度が向上する。
図1:QPCRのメカニズム
QPCRのためのプライマーの設計方法
QPCRのプライマー設計は、アッセイの信頼性、正確性、感度を向上させるために非常に重要です。
以下に、QPCRのプライマー設計のガイドラインを示します。
-
- PCR産物/アンプリコンサイズ – PCR産物のサイズは50-210塩基対であることが望ましい。
-
- プライマーの長さ – プライマーの長さは19-23塩基であることが望ましい。
- GC content – プライマーのGC contentは35-65%であることが望ましい。
- 融点(Tm)-プライマーの融点は、60〜68℃であることが望ましい。アッセイ時のアニーリング温度は、プライマーのTmより5℃低い温度とする。
-
- Exon-exon junction – cDNAをQPCRで増幅する場合、プライマーはexon-exon junctionにまたがるようにし、混入したDNAが増幅されないようにする。
-
- Repeats and runs – 2塩基の繰り返し(TCTCTCTCTC)や繰り返し塩基(例:TAAAAAAAGC)は避けるべき。
- 3’相補性 – フォワードおよびリバースプライマーの3’末端の相補領域は、プライマーダイマーの形成を防ぐため、避けるべきです。
- 3’安定性-アニーリングの安定性を高めるため、プライマーの3’末端にはGまたはC残基を含むことが望ましい。
- GCクランプ – プライマーの5’末端に1〜2個のGCクランプをつけると、アニーリングの特異性が高まる。
- 特異性 – プライマーの特異性は、BLASTで確認する。
- SNPs – プライマーに既知のSNP(一塩基多型)変異が含まれていないこと。
プライマー設計には、Primer3、Primer-BLAST、IDT PrimerQuest、Primer Bank、OATなどのオンラインツールを使用することができます。
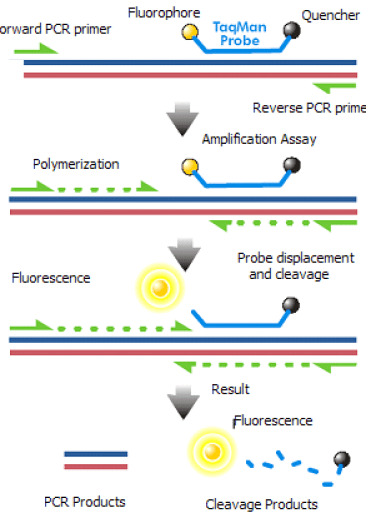 図2:プライマーダイマーの形成
図2:プライマーダイマーの形成
QPCRでは、プライマーダイマーが形成されないようにプライマーを設計する必要があります。
PCR産物の検出に蛍光色素を使用する場合、これらの色素もプライマーダイマーと結合し、偽陽性となるため、重要です。
結論
QPCR は、PCR 産物の検出と定量に用いられる。
QPCR では、結果の精度を高めるためにプライマーの設計が非常に重要です。
そのため、QPCRのプライマー設計は、ガイドラインに沿って慎重に行うことが重要です。
