主な違い – 有機酸 vs 無機酸
一般に、酸は塩基を中和することができる化合物です。
酸は、水に加えるとヒドロニウムイオン (H3O+) を生成することができます。
一般的に、酸は腐食性の物質で、室温では液体です。
酸は、溶液にプロトン(H+)イオンを供与するか、溶液中に存在する電子豊富な化合物から電子対を受け入れることができます。
有機酸と無機酸の主な違いは、有機酸は酸性の性質を持つ有機化合物で、一般に弱酸であるのに対し、無機酸は酸性の性質を持つ無機化合物で、そのほとんどが強酸である点です。
有機酸とは?
有機酸は、酸性の性質を持つ有機化合物です。
有機化合物である以上、有機酸は構造中に炭素原子を持つ必要がある。
有機酸の代表的なものはカルボン酸です。
カルボン酸の分子式はRCOOHで示される。
酸性の性質をもたらす官能基は-COOHです。
この官能基の水素原子はH+イオンとして放出されます。
これは、酸素原子が電子に富み、H原子よりも電気陰性度が高いためです。
したがって、このH原子は-COOH基から容易に分離することができる。
有機酸は酸性のため、pH7以下の値を示し、リトマス試験紙が真っ赤になり、味も酸っぱい。
有機酸には2種類ある。
- 強酸性有機酸
- 弱アルカリ性有機酸
弱酸は水溶液中で共役塩基とH+イオンとの平衡状態にあるのに対し、強酸は水溶液中で完全に解離し平衡状態にない。
有機酸の多くは、水中で部分的に解離するため弱酸である(例:エタン酸)。
しかし、ほとんど全ての有機酸は有機溶媒に溶解する。
解離してできる陰イオンの安定性によって、有機酸は強酸になったり弱酸になったりする。
酢に含まれる。
無機酸とは?
無機酸とは、酸性の性質を持つ無機化合物のことである。
つまり、無機酸化合物は水溶液にH+イオンを供与したり、電子豊富な化合物から電子対を受容したりすることができる。
無機酸は鉱酸とも呼ばれる。
無機酸には、構造中に酸素原子を持つものと、持たないものがあります。
例えば、H2SO4は酸素原子を持つ無機酸です。
しかし、同じく無機酸であるHCNは、酸素原子を持たない。
無機酸は有機酸とは異なり、基本的に炭素原子を構造中に持っていない。
無機酸の中には炭素原子を持つものもあれば、持たないものもあります。
例えば、HCNは無機酸でありながら炭素原子を有している。
HCNは有機酸と異なり、唯一のC-H結合を持つため、水中でH+イオンとCN-イオンに容易に解離するため、有機酸ではありません。
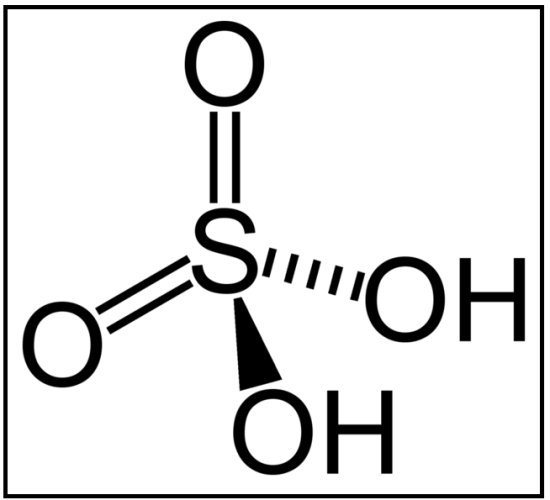 :図2 無機酸である硫酸の構造。
:図2 無機酸である硫酸の構造。
有機酸と無機酸の違い
定義
有機酸。
有機酸は、酸性の性質を持つ有機化合物です。
無機酸:酸性を示す無機化合物。
原点
有機酸:ほとんどの有機酸は、生物学的起源を持つ。
無機酸:無機酸の多くは、鉱物資源など非生物的な起源を持つ。
水への溶解度
有機酸。
有機酸は水にあまり溶けない。
無機酸:ほとんどの無機酸は、水によく溶ける。
酸味の度合い
有機酸のこと。
有機酸は、一般に弱酸です。
無機酸:無機酸の多くは強酸です。
原子の構成
有機酸のこと。
有機酸は、基本的に炭素原子を含む構造です。
無機酸:無機酸は構造中に炭素原子を持つ場合と持たない場合があります。
結論
有機酸も無機酸も、塩基を中和する、プロトン(H+イオン)を供与したり電子対を受け入れたりできる、青いリトマスを赤くする、などの酸性の性質を示す物質です。
いずれの物質も水溶液中ではヒドロニウムイオン(H3O+)を形成する。
有機酸と無機酸の大きな違いは、有機酸が有機化合物であるのに対して、無機酸は無機化合物であることである。
