シャペロンとシャペロニンの主な違いは、シャペロンが他の高分子構造体の共有結合による折りたたみや展開、組み立てや分解を助けるタンパク質であるのに対し、シャペロニンは分子シャペロンの一種で、変性したタンパク質が正しく折りたたむために好ましい条件を提供し、凝集を防いでいる点である。
また、シャペロンは分子量70-100kDaの単量体であるのに対し、シャペロニンは分子量800kDaのオリゴマーです。
シャペロンとシャペロニンは、主にタンパク質のフォールディングに関与する分子シャペロンタンパク質の2つのグループです。
一般に、その多くは熱ショックタンパク質(HSP)です。
主な対象分野
- シャペロンとは
– 定義、構造、機能 - シャペロニンとは
– 定義、構造、機能 - シャペロンとシャペロニンの類似点とは?
– 共通点の概要 - シャペロンとシャペロニンの違いとは?
– 主な違いの比較
この記事の重要な単語
シャペロン、シャペロニン、変性タンパク質、熱ショックタンパク質(HSP)、タンパク質フォールディング
シャペロンとは
シャペロンは、分子シャペロンの一種で、タンパク質のフォールディングと本来の構造へのアセンブリを担っている。
また、誤ったコンフォメーションになったタンパク質のリモデリングにも関与している。
シャペロンの多くは、熱ショックタンパク質(HSP)です。
また、分子量70-100kDaの単量体です。
さらに、シャペロンのファミリーには、Hsp70ファミリー、Hsp90ファミリー、Hsp33ファミリーの3つがあります。
Hsp70ファミリー
Hsp70ファミリーは、分子量約70kDaのHsp70というタンパク質から構成されています。
また、ATPase活性を示す。
細胞質では、細菌ではDnaKが、高等真核生物ではストレス誘導性のHsp72と構成性のHsp73がHsp70のタイプであることが重要です。
一方、Hsp70はHsp40(バクテリアではDnaJ)やGrpEと相互作用している。
ここで、Hsp40はATPの加水分解を促進し、GrpEはヌクレオチド交換の因子として機能する。
Hsp90ファミリー
Hsp90ファミリーは、Hsp70ファミリーに比べて代表的なものではありません。
さらに、細胞にはストレス依存的に大量のHsp90が存在する。
HtpGは、細菌におけるHsp90ファミリーのタンパク質です。
Hsp33ファミリー
Hsp33ファミリーは活性型システインとZnを含む。
熱ショックで合成が誘導され、酸化ショックで活性化される。
さらに、シャペロンにはフォルダーゼとホールドアゼがあります。
ここで、フォルダーゼは、ATP依存的にタンパク質のフォールディングを補助する。
フォルダーゼの例としては、GroEL/GroES、DnaK、DnaJ、GrpEなどが挙げられる。
一方、ホルダーゼはフォールディングの中間体に結合して、その凝集を防ぐ役割を担っている。
シャペロニンとは
シャペロンは、分子シャペロンのもう一つのタイプで、特に変性したタンパク質の正しいフォールディングを補助する。
シャペロニンの主な特徴は、その形状にある。
一般に、シャペロンは7,8または9個のモノマーユニットからなる2つのリング構造を持っています。
そのため、シャペロニンは分子量800kDaのオリゴマーです。
一方、シャペロニンのファミリーには、Hsp60ファミリーとTRiCファミリーの2つがあります。
Hsp60ファミリー
細菌では、Hsp60ファミリーはGroELというタンパク質から構成されており、7つのサブユニット、それぞれ60kDaの2つのリングを持つ。
さらに、ATPase活性を持つ。
また、GroELの補酵素はGroESであり、ポリペプチドのフォールディングを促進する。
一方、高等真核生物では、Hsp60とその補因子であるHsp10がHsp60ファミリーのタンパク質です。
これらのタンパク質は、ミトコンドリアにも存在する。
しかし、Cpn60やCpn20と呼ばれるHsp60ファミリーのタンパク質は、高等真核生物の葉緑体に存在する。
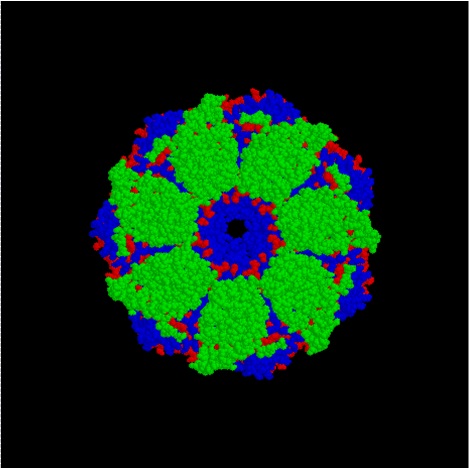 :図2 GroEL/GroES タンパク質複合体
:図2 GroEL/GroES タンパク質複合体
TRiCファミリー
TRiCファミリーは、8個のサブユニットが2つのリングを形成し、それぞれ55kDaの大きさを持つTRiCタンパク質を含む。
さらに、バクテリアと高等真核生物の両方の細胞質に存在する。
シャペロンとシャペロニンの類似性
- シャペロンとシャペロニンは、タンパク質のフォールディングとアンフォールディングを助ける2つのタンパク質群です。
- シャペロンとシャペロニンは、タンパク質のフォールディングとアンフォールディングを助ける2つのタンパク質群であり、さらに、タンパク質の組み立てと分解を助ける。
- シャペロンとシャペロニンは、タンパク質のフォールディングとアンフォールディングを補助し、さらに、タンパク質のアセンブリとディスアセンブリを補助する2つのタンパク質群です。
- これらのタンパク質は、進化上非常によく保存されている。
- さらに、ATPase活性を示す。
- ほとんどが熱ショックタンパク質(HSP)です。
シャペロンとシャペロニンの違いについて
定義
シャペロンとは、他の高分子構造体の共有結合による折りたたみや展開、組み立て、分解を助けるタンパク質を指し、シャペロニンとは、変性したタンパク質が正しく折りたたまれるための好条件を提供し、凝集を防ぐタンパク質を指す。
これがシャペロンとシャペロニンの根本的な違いです。
サイズ
シャペロンが分子量70-100kDaの単量体であるのに対し、シャペロニンは分子量800kDaのオリゴマーです。
形状
シャペロンの多くは熱ショックタンパク質(HSP)であるのに対し、シャペロンはドーナツを2つ重ねて樽状にしたような形をしている。
機能
さらに、シャペロンとシャペロニンのもう一つの違いは、シャペロンがタンパク質の折り畳み、展開、組み立て、分解を担うのに対し、シャペロニンは変性したタンパク質の正しい折り畳みを担い、凝集を防いでいることである。
例
シャペロンとしては、DnaK、DnaJ、GrpE、HtpG、Hsp33などが、シャペロニンとしては、GroEL/GroES、TRiCなどが挙げられる。
結論
シャペロンとは、簡単に言えば、タンパク質の折り畳み、展開、組み立て、分解を行い、本来の構造に戻す役割を持つ分子シャペロンタンパク質の一群のことである。
また、その多くは熱ショックタンパク質です。
また、その多くは熱ショックタンパク質であり、70-100kDaの単量体です。
一方、シャペロンはもう一つの分子シャペロンタンパク質で、変性したタンパク質を正しくフォールディングする役割を担っている。
さらに、タンパク質の凝集を防ぐ働きもあります。
シャペロンは2つのリング構造を持つオリゴマーであり、分子量は800kDaです。
従って、シャペロンとシャペロニンの主な違いは、その構造と機能です。
