主な相違点 – ガルバニックセルと電解セル
物理化学では、セルは化学物質と電気を関連付けるために使用されるシステムです。
言い換えれば、セルは、化学化合物から電流を生成するため、または化学反応を完了させるために電流を流すために使用することができます。
このようなセルの代表的なものにガルバニックセルと電解セルがあります。
ガルバニ電池は電気化学電池とも呼ばれます。
いずれも電気を流すことのできるイオンからなる溶液と、その溶液の電位を測定するための電極が必要です。
ガルバニック電池と電解槽の主な違いは、ガルバニック電池が化学エネルギーを電気エネルギーに変換するのに対し、電解槽は電気エネルギーを化学エネルギーに変換することです。
ガルバニックセルとは
ガルバニック電池は、化学反応を利用して電気を作り出す電気化学電池です。
この化学反応は、酸化還元反応と呼ばれるもので、酸化反応と還元反応が同時に起こります。
しかし、この酸化反応と還元反応は、2つの別々の溶液で起こっているのです。
通常、1つのセルは2つのハーフセルから構成されています。
それぞれのハーフセルは、その電極に対応する金属塩を含む溶液に浸された電極で構成されている。
2つのハーフセルは、ワイヤーを介して互いに接続されている。
2つの溶液はソルトブリッジによって互いに接続されています。
ガルバニ電池は、2つの溶液に浸された2つの金属電極で構成されています。
それぞれの金属電極は、それぞれの金属の溶解した塩を含む溶液に浸かっています。
例えば、2つの金属電極が銅と亜鉛の場合、銅電極は硫酸銅溶液に浸し、亜鉛電極は硫酸亜鉛溶液に浸すことができます。
また、この2つの溶液が完全に分離している場合もあります。
この場合、2つの溶液は塩の橋でつながっている。
しかし、時には2つの溶液が多孔質の円盤で隔てられていることもあります。
この場合、イオンはこの孔を通って移動することができる。
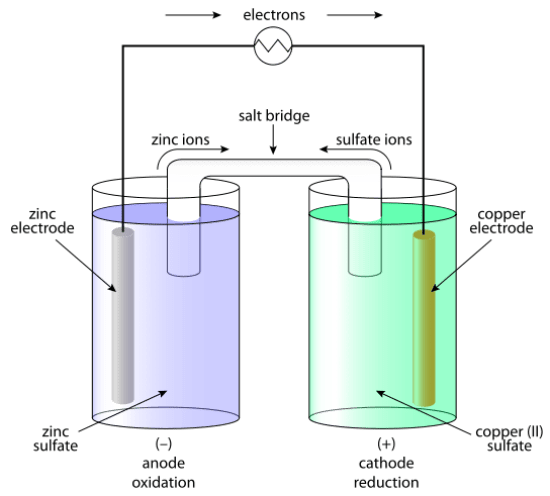 :図1 ガルバニックセル
:図1 ガルバニックセル
2つの電極は、一本の針金で互いに接続されています。
このワイヤーを電圧計に接続することで、セルの電位を測定・制御することができる。
金属亜鉛は電子を失いやすい。
そのため、亜鉛電極のZn原子は電子を放出し、正電荷の陽イオンになることができます。
そして、このZn+2イオンは電極が浸かっている溶液に放出されます。
これにより、亜鉛電極の質量は減少していきます。
亜鉛原子から放出された電子は、外部回路を通じて銅溶液に移動します。
溶液中の銅イオンはこの電子を得て、銅原子になることができます。
この銅原子は銅電極に析出する。
したがって、銅電極の質量は増加する。
同様に、システム内で起こる化学反応により、外部ワイヤーを通して電流が発生します。
したがって、ガルバニ電池は、化学エネルギーを電気エネルギーに変換していることが知られています。
ここでは、陽極で酸化反応、陰極で還元反応が起こるため、陽極はマイナス、陰極はプラスとなる。
電解槽とは?
電解槽とは、化学反応の進行に電流を用いる槽のことである。
この電池では、非自発的な反応を得るために電流が使用される。
これはガルバニ電池の逆です。
ガルバニ電池で起こる自発的な酸化還元反応は、電解槽で電圧をかけることによって逆転させることができます。
電解槽で行われるプロセスは電気分解として知られています。
電解槽の陽極は正に帯電し、陰極は負に帯電している。
陰極では酸化反応が起こり、陽極では還元反応が起こる。
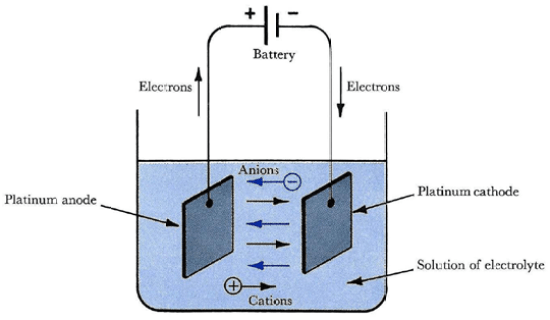 図2:電解セル
図2:電解セル
例えば、Zn電極とCu電極を使用する場合、適当な電圧をかけることで上記と逆の過程を得ることができる。
このとき、Zn電極にはZnが析出し、Cu電極は酸化によりその質量を減少させる。
しかし、電解槽では、2つの電極を同じ電解液に浸している。
ガルバニ電池と電解槽の違い
定義
ガルバニ電池:化学反応を利用して電気を作り出す電気化学電池。
電解槽:化学反応を進行させるために電流を使用する槽。
テクニック
ガルバニ電池:化学エネルギーを電気エネルギーに変換する。
電解槽:電気エネルギーを化学エネルギーに変換する。
化学反応
ガルバニ電池:自発的な反応が起こる。
電解槽:電解槽では、非自発的な反応が起こる。
陽極と陰極
ガルバニ電池: 陽極は負に、陰極は正に帯電している。
電解槽:陽極が正電荷、陰極が負電荷を帯びる。
結論
ガルバニ電池や電解槽は、電気と化学物質を関連づけるために用いられるシステムです。
これらの電池は、化学エネルギーを電気エネルギーに変換することも、電気エネルギーを化学エネルギーに変換することもできる。
ガルバニ電池と電解槽の主な違いは、ガルバニ電池が化学エネルギーを電気エネルギーに変換するのに対し、電解槽は電気エネルギーを化学エネルギーに変換する点です。
