正常ヘモグロビンと鎌状赤血球ヘモグロビンの主な違いは、正常ヘモグロビンではβ鎖の表面の6位にグルタミン酸があることである。
しかし、鎌状赤血球ヘモグロビンでは、同じ位置のグルタミン酸に代わってバリンが存在する。
さらに、正常ヘモグロビンではグルタミン酸が強い親水性を示すのに対し、バリンは鎌状赤血球ヘモグロビンをより疎水的にしている。
さらに、正常なヘモグロビンでは、赤血球が両凹型になって静脈を自由に流れるのに対し、鎌状赤血球は三日月型になって静脈の分岐点に張り付いてしまう。
正常型ヘモグロビンと鎌状赤血球ヘモグロビンは、ほぼすべての脊椎動物の赤血球に含まれる含鉄酸素輸送金属蛋白質であるヘモグロビンの2つの構造型です。
一般に、正常型ヘモグロビンはヘモグロビンA、鎌状赤血球ヘモグロビンはヘモグロビンSと呼ばれています。
主な対象分野
- 正常なヘモグロビンとは
– 定義、構造、重要性 - 鎌状赤血球ヘモグロビンとは
– 定義、構造、重要性 - 正常ヘモグロビンと鎌状赤血球ヘモグロビンの類似点とは?
– 共通点の概要 - 正常ヘモグロビンと鎌状赤血球ヘモグロビンの違いについて
– 主な違いの比較
正常なヘモグロビンとは?
正常なヘモグロビンは、通常、脊椎動物の赤血球中に存在する。
具体的には、ヘモグロビンA(hemoglobin A1またはα2β2)は、赤血球の95%に存在する最も一般的なタイプの正常ヘモグロビンです。
また、2つのαサブユニットと2つのβサブユニットを持つ4量体(α2β2)です。
これ以外に、ヘモグロビンA2、ヘモグロビンFが成人の正常ヘモグロビンのマイナータイプとして存在する。
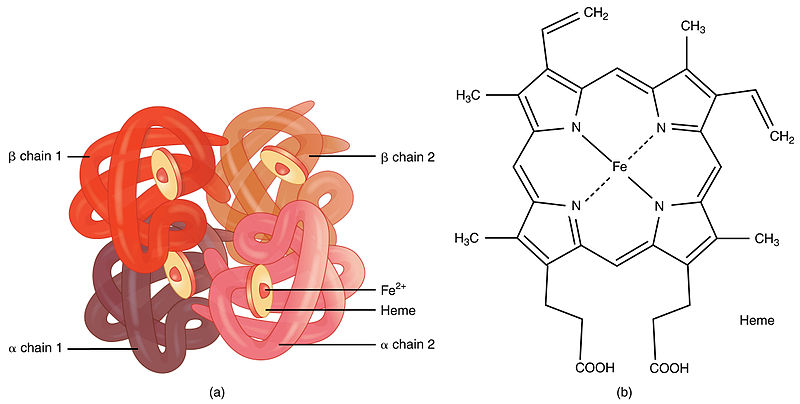
図1:ヘモグロビンの構造
ヘモグロビンは、赤血球の中にある鉄を含む酸素運搬用の金属タンパク質です。
ヘモグロビンは4つの球状タンパク質の集合体で、それぞれのタンパク質鎖は非タンパク質の補欠分子であるヘム基と結合している。
ヘム基は通常、ポルフィリンと呼ばれる複素環に鉄(Fe)イオンが保持されたものです。
また、ヘモグロビンの主な働きは、肺から全身に酸素を運搬することである。
さらに、二酸化炭素を肺に運ぶ働きもあります。
鎌状赤血球ヘモグロビンとは?
鎌状赤血球ヘモグロビンは、正常なヘモグロビンの変異型です。
鎌状赤血球ヘモグロビンの種類は、β鎖遺伝子に変異があるヘモグロビンSで、ヘモグロビンの性質に変化が生じ、その結果、赤血球が鎌状になるものです。
ここで、鎌状赤血球ヘモグロビンには、6位のグルタミン酸(E/Glu)をバリン(V/Val)に置換する(E6V置換)1点変異が存在する。
通常、グルタミン酸は親水性が高く、バリンは疎水性が高い。
そのため、この置換により新たな疎水性スポットが形成される。
 :図2 正常な赤血球と鎌状赤血球
:図2 正常な赤血球と鎌状赤血球
さらに、脱酸素状態では、正常ヘモグロビンも鎌状赤血球ヘモグロビンも疎水性スポットが互いにくっつき、鎖状に凝集していることがわかる。
しかし、鎌状赤血球ヘモグロビンは、正常ヘモグロビンに対してアミノ酸組成が全く同じではない。
そのため、鎌状赤血球ヘモグロビンでは、この凝集の仕方が異なる。
その上、β鎖のバリンは、異なる疎水性パッチに結合する。
その結果、鎌状赤血球ヘモグロビンの4量体同士がくっつき、長い繊維が形成される。
そのため、鎌状赤血球ヘモグロビンは、独立したままではなく、重合する。
その結果、重合した鎌状赤血球ヘモグロビンは、鎌状赤血球を異常な鎌状に変形させる。
重要なことは、低酸素濃度下では、鎌状赤血球は静脈の分岐点でくっつきやすくなることである。
また、ヘテロ接合体では、ヘモグロビンAとヘモグロビンSが混在しており、通常、この状態を「鎌状赤血球形質」と呼んでいる。
一方、ホモ接合体では、鎌状赤血球貧血になります。
正常型ヘモグロビンと鎌状赤血球ヘモグロビンの類似性
- 正常型ヘモグロビンと鎌状赤血球ヘモグロビンは、ヘモグロビンの構造上の違いによるものです。
- 一般にヘモグロビンは鉄を含む金属タンパク質で、すべての脊椎動物の赤血球に存在する。
- また、多サブユニットの球状タンパク質からなる四次構造を持っています。
- その働きは、肺から血液を通して全身に酸素を運ぶことです。
正常型ヘモグロビンと鎌状赤血球ヘモグロビンの違いについて
定義
正常ヘモグロビンとは、血液中の酸素を運搬する色素で、赤血球中の主要なタンパク質です。
一方、鎌状赤血球ヘモグロビンとは、異常ヘモグロビンの中で最も多く、鎌状赤血球形質および鎌状赤血球貧血の基礎となるものを指す。
ヘモグロビンの種類
正常なヘモグロビンの種類には、成人ではヘモグロビンA、ヘモグロビンA2、ヘモグロビンFがあり、鎌状赤血球ヘモグロビンの種類はヘモグロビンSです。
アミノ酸の量の違いについて
正常なヘモグロビンではβ鎖表面の6位にグルタミン酸が存在するが、鎌状赤血球ヘモグロビンでは同じ位置にグルタミン酸の代わりにバリンが存在する。
アミノ酸置換の効果
グルタミン酸は正常なヘモグロビンでは強い親水性を示すが、バリンは鎌状赤血球ヘモグロビンをより疎水的にする。
重合
低酸素濃度下では、正常なヘモグロビンは重合しにくく、鎌状赤血球ヘモグロビンは重合して結晶となり、赤血球を鎌状に歪ませる傾向があります。
赤血球の形
正常なヘモグロビンは赤血球を両角にし、鎌状赤血球は三日月型にする。
低酸素濃度下での溶解性
低酸素濃度下では、正常ヘモグロビンは溶解しやすく、鎌状赤血球ヘモグロビンは溶解しにくい。
静脈を流れる
正常なヘモグロビンでは赤血球は自由に静脈を流れるが、鎌状赤血球ヘモグロビンでは静脈の分岐点で鎌状赤血球が粘着性を持つようになる。
効果
正常ヘモグロビンの変異はヘモグロビン異常症やサラセミアの原因となり、鎌状赤血球ヘモグロビンは鎌状赤血球症や鎌状赤血球貧血の原因となる。
結論
正常ヘモグロビンは、通常の血球に存在するヘモグロビンの一種です。
一般に、成人ではヘモグロビンAが正常ヘモグロビンとして最も多く存在する。
また、正常ヘモグロビンは重合を起こさないため、正常な赤血球は両凹構造を維持することができる。
そのため、低酸素濃度下では、正常な赤血球は自由に静脈内を浮遊することができる。
一方、鎌状赤血球ヘモグロビンは、正常ヘモグロビンの突然変異で、β鎖の表面の6位のグルタミン酸がバリンに置き換わったものです。
その結果、鎌状赤血球ヘモグロビンは疎水性が高くなり、ヘモグロビン4量体が重合して、正常な両凹型が鎌状に歪んでしまうのです。
さらに、酸素濃度が低い状態では、このタイプのヘモグロビンは静脈の分岐部で粘着性を帯びるようになる。
最終的に鎌状赤血球は鎌状赤血球貧血を引き起こす。
このように、正常なヘモグロビンと鎌状赤血球ヘモグロビンの大きな違いは、その構造と作用にあります。
