主な違い – 価電子結合理論 vs 分子軌道理論
原子は、電子が存在する軌道で構成されています。
この原子軌道は、さまざまな形やエネルギー準位で存在します。
原子が他の原子と組み合わさって分子内にあるとき、これらの軌道は異なる方法で配置されます。
この軌道の配置によって、化学結合や分子の形や幾何学的な形状が決定されます。
これらの軌道の配置を説明するために、価電子結合理論と分子軌道理論のいずれかを用いることができる。
価電子結合論と分子軌道論の大きな違いは、価電子結合論が軌道の混成を説明するのに対し、分子軌道論は軌道の混成について詳しく説明しないことである。
価電子結合理論とは
価電子結合理論とは、分子内の原子の化学結合を説明するための基礎理論です。
価電子結合理論では、軌道の重なりによって電子が対になることを説明する。
原子の軌道には、主にS軌道、P軌道、D軌道が存在する。
価電子結合理論によれば、2つのs軌道が重なったり、p軌道が頭同士で重なったりするとシグマ結合が形成されます。
平行な2つのp軌道の重なりはπ結合を形成する。
したがって、単結合はシグマ結合のみを含むが、二重結合はシグマ結合とπ結合を含む。
三重結合はシグマ結合と2つのπ結合を含むことがあります。
H2のような単純な分子は、水素(H)原子がs軌道だけで構成されているため、軌道の重なりだけでシグマ結合を形成する。
しかし、不対電子を持つs軌道とp軌道からなる原子の場合、価電子結合理論では「混成」と呼ばれる概念が存在する。
軌道が混成されると、ハイブリッド軌道になる。
このハイブリッド軌道は、軌道間の反発が最小になるように配置されている。
以下にハイブリッド軌道のいくつかを紹介する。
sp オービタル
s軌道とp軌道が混成してできるハイブリッド軌道です。
したがって、sp軌道はs軌道の特徴を50%、p軌道の特徴を50%持っています。
spハイブリッド軌道からなる原子は、ハイブリッドしていないp軌道を2つ持っています。
したがって、その2つのp軌道は平行に重なり合い、2つのπ結合を形成することができる。
混成軌道の最終的な配置は直線的です。
sp2Orbital
このハイブリッド軌道は、s軌道と2つのp軌道が混成して形成されている。
したがって、このsp2ハイブリッド軌道は、約33%のs軌道の性質と約67%のp軌道の性質で構成されています。
このような混成を行う原子は、混成されていない1つのp軌道で構成されている。
ハイブリッド軌道の最終的な配置は、三角形の平面となる。
sp3Orbital
s軌道と3つのp軌道が混成してできたハイブリッド軌道です。
したがって、このsp3ハイブリッド軌道は、約25%のs軌道の性質と約75%のp軌道の性質で構成されています。
このような混成をする原子は、混成していないp軌道を持たない。
ハイブリッド軌道の最終的な配置は四面体です。
sp3d1Orbital
この混成軌道は、s軌道、3つのp軌道、およびd軌道を含んでいます。
これらの混成軌道が、最終的な分子の形状を決定する。
上の図は、CH4分子の形状を示したものです。
これは四面体です。
灰色は炭素原子のsp3混成軌道、青色は水素原子のs軌道で、炭素原子の混成軌道と重なり合って共有結合を形成している。
分子軌道理論とは?
分子軌道理論とは、分子の化学結合を仮想的な分子軌道を用いて説明する理論です。
また、原子軌道が重なり合う(混ざり合う)ことで分子軌道が形成されることも説明されている。
この理論によると、分子軌道は最大で2個の電子を保持することができる。
これらの電子は、電子間の反発を最小にするために、逆のスピンを持っています。
これらの電子は結合電子対と呼ばれる。
この理論では、分子軌道は結合分子軌道と反結合分子軌道の2種類に分けられる。
結合分子軌道
結合分子軌道は、原子軌道(この分子軌道の形成に参加した原子軌道)よりエネルギーが低い。
そのため、結合軌道は安定です。
結合分子軌道にはσという記号が与えられている。
反結合分子軌道
反結合分子軌道は、原子軌道よりも高いエネルギーを持つ。
そのため、結合軌道や原子軌道に比べ、不安定です。
反結合分子軌道には、σ(*)という記号が与えられている。
結合分子軌道は、化学結合を形成させる。
この化学結合にはσ結合とπ結合があります。
反結合軌道は、化学結合の形成には関与しない。
結合の外側に存在する。
シグマ結合は、頭から頭へ重なったときに形成されます。
π結合は、軌道の内側と外側が重なり合って形成される。
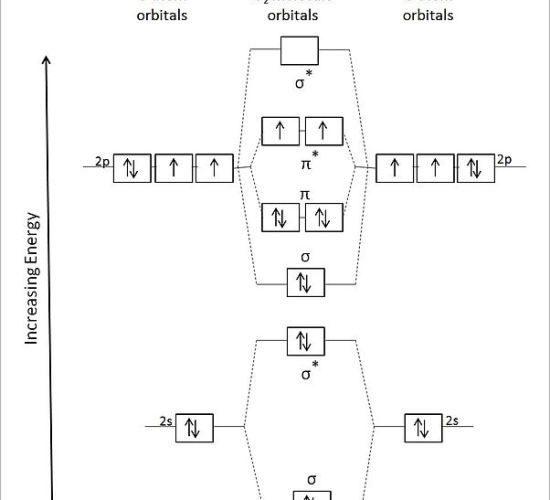 :図2 酸素分子の結合を表す分子軌道図
:図2 酸素分子の結合を表す分子軌道図
上の図では、2つの酸素原子の原子軌道が左側と右側に示されている。
中央にはO2分子の分子軌道が結合軌道と反結合軌道として示されている。
価電子結合理論と分子軌道理論の違い
定義
価電子結合理論。
分子内の原子の化学結合を説明するための基礎理論。
分子軌道説。
分子の化学結合を仮想的な分子軌道で説明する理論。
分子軌道
価電子結合理論。
価電子結合理論では、分子軌道の詳細はわからない。
原子軌道の結合を説明する。
分子軌道説。
分子軌道理論:分子軌道をベースに発展させた理論。
軌道の種類
価電子結合理論。
価電子結合理論:ハイブリッド軌道を記述する。
分子軌道論。
結合分子軌道と反結合分子軌道を記述する。
ハイブリッド化
価電子結合理論。
価電子結合理論:分子軌道の混成を説明する理論。
分子軌道説。
軌道の混成は分子軌道説では説明できない。
結論
分子内の原子間の化学結合を説明するためには、価電子結合論と分子軌道論が使われる。
しかし、価電子結合論は複雑な分子の結合を説明することはできない。
二原子分子には適している。
しかし、分子軌道法はどのような分子でも結合を説明することができます。
そのため、価電子結合論よりも高度な応用が可能です。
これが価電子結合論と分子軌道論の違いです。
