主な違い – 窒素と硝酸塩の違い
窒素は周期表第15族に属する化学元素です。
水素、酸素、炭素などの他の元素と結合して、さまざまな種類の分子やイオンを形成することができます。
硝酸イオンは、窒素原子が3個の酸素原子と結合して陰イオンを形成しているイオンの1つです。
硝酸イオンは、異なる陽イオンや硝酸エステルなどの共有結合化合物と結合することで、異なる塩化合物を形成することができます。
窒素と硝酸塩の主な違いは、窒素が化学元素であるのに対し、硝酸塩は陰イオンであることです。
窒素ってなんだろう
窒素は周期表第15族に属する化学元素で、化学記号は “N “です。
窒素はその電子配置からpブロック元素であり、[He] 2s22p3です。
窒素の原子番号は7で、相対原子質量は約14amuです。
常温常圧では、無色、無臭、無味の2原子化合物として存在する。
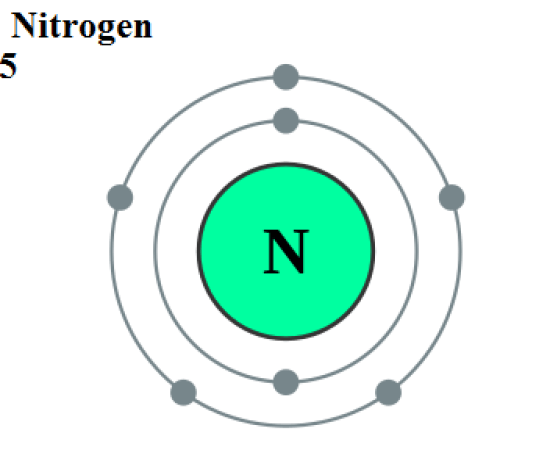 :図1 窒素の原子構造
:図1 窒素の原子構造
窒素は不対電子を3個持っています。
電子の殻を完成させるために、3つの共有結合を形成する傾向があります。
窒素は大気中にN2ガスとして存在する。
これは2原子の共有結合化合物です。
2つの窒素原子の間に三重結合があります。
窒素には2つの安定同位体があります。
N-14とN-15です。
しかし、N-14は最も安定で、最も豊富な同位体です。
この同位体の存在比は約99%です。
窒素はさまざまな化合物を形成する。
例えば、アミド、アミン、硝酸塩、窒化物、アジ化物、酸化物、シアン化物などです。
窒素循環は、環境中の窒素の循環を示す。
窒素は、地球上の生命にとって不可欠な元素です。
核酸やタンパク質など、多くの重要な生体分子の化学組成に含まれている。
そのため、窒素は大気中、生物体内、土壌中に存在し、それらの間を循環しています。
硝酸塩とは
硝酸塩は、化学式 NO3- で表される陰イオンです。
このイオンのモル質量は62g/molです。
共有結合の化合物です。
ルイス構造では、窒素原子に2つの酸素原子が単結合で結合し、もう1つの酸素原子は二重結合で結合しています。
したがって、硝酸イオンは共鳴構造を持っています。
しかし、このイオンの実際の構造は、すべての共鳴構造のハイブリッド構造です。
この化合物の形状は、三角形の平面です。
硝酸イオンにプロトンが結合すると、硝酸と呼ばれる。
硝酸は、有機化学のほとんどの合成反応に必要な成分である。
例えば、ベンゼンを硝酸、硫酸、水の混合液で反応させるとニトロベンゼンが合成されます。
硝酸イオンは、イオン性化合物中に塩として、また自由水性イオンとして存在する。
硝酸塩は鉱床として地球上に多く存在する。
例としては、硝酸アンモニウム、硝酸ナトリウム、硝酸カリウムなどがあります。
硝酸塩は、陽イオンと結合した硝酸イオンからなるイオン性化合物です。
硝酸塩の共有結合化合物としては、硝酸のエステルなどがあります。
窒素循環において、硝化細菌(ニトロバクター)は亜硝酸イオンを硝酸イオンに変換する。
しかし、脱窒細菌(Pseudomonasなど)は、硝酸塩を窒素ガスに変換することができる。
窒素と硝酸塩の違い
定義
窒素。
窒素は周期表第15族に属する化学元素で、化学記号は “N” です。
硝酸塩。
硝酸塩は、化学式NO3-で表される陰イオンです。
自然
窒素 窒素は化学元素の一つ。
硝酸塩。
硝酸塩は陰イオンです。
電荷
窒素。
窒素原子は正味の電荷をもたない。
硝酸塩。
硝酸イオンは-1電荷を持つ。
窒素サイクル
窒素のこと。
窒素は、アンモニア、亜硝酸塩、硝酸塩など、さまざまな形で循環している。
硝酸塩。
窒素循環の中で、硝化菌はアンモニウムイオンを硝酸イオンに変換し、脱窒菌は硝酸イオンを窒素ガスに変換する。
化合物
窒素 窒素は無機化合物、有機化合物など様々な化合物を形成する。
硝酸塩。
硝酸イオンは、塩や共有結合化合物中に存在する。
結論
窒素は化学元素です。
硝酸イオンは電荷が-1である陰イオンです。
窒素はさまざまな形で窒素循環の中を循環しているが、硝酸イオンは硝化と脱窒のステップの中で見出すことができる。
窒素と硝酸塩の主な違いは、窒素は化学元素であるのに対し、硝酸塩は陰イオンであることです。
