主な違い – 活性型錯体 vs 遷移状態
化学反応とは、物質の分子構造またはイオン構造の再配列を伴うプロセスであり、物理的形態の変化や核反応とは異なるものです。
化学反応は、1つのステップで直接起こる場合と、いくつかのステップを経て起こる場合があります。
複数の段階を経て起こる化学反応について説明した用語に活性錯体、遷移状態があります。
活性錯体とは、化学反応の進行過程で形成される中間分子の集合体を指す。
ここで、化学反応の進行とは、反応物質が生成物に変換されることを指す。
化学反応の遷移状態とは、最もポテンシャルエネルギーの高い中間体のことである。
活性化錯体と遷移状態の大きな違いは、活性化錯体がすべての可能な中間体を指すのに対し、遷移状態は最も高いポテンシャルエネルギーを持つ中間体を指すことである。
アクティベート・コンプレックスとは
活性化錯体とは、化学反応の進行中に形成される中間分子の集合体のことである。
活性化錯体とは、反応物の原子が不安定に配置された状態です。
そのため、中間体や活性化錯体は反応物よりも高いポテンシャルエネルギーを持っています。
その不安定性から、活性化錯体は非常に短い時間しか存在しない。
活性化錯体は、最終生成物を形成することもあれば、しないこともあります。
つまり、活性化錯体は、生成物を形成するために前進するよりも、反応物を与えて後退することもあります。
化学反応には、化学結合の切断と形成があります。
活性化錯体は、異なる原子の間で結合が切れたり形成されたりすることで形成されます。
図1: 中間体の違いによる化学反応の違い
しかし、化学結合を切断したり形成したりするためには、反応物にエネルギーが供給される必要があります。
そのため、反応を起こすためには、反応物同士が適切な向きで衝突する必要がある。
このような衝突によって活性化錯体が形成される。
遷移状態とは
遷移状態とは、化学反応において最も高いポテンシャルエネルギーを持つ中間体のことである。
中間体が1つしかない化学反応では、その中間体が遷移状態として扱われる。
2段階以上の化学反応は、反応物のみの初期段階、中間体のある遷移状態、生成物のある最終段階の3つの段階があります。
したがって、遷移状態とは、反応物が生成物に変換される段階を指す。
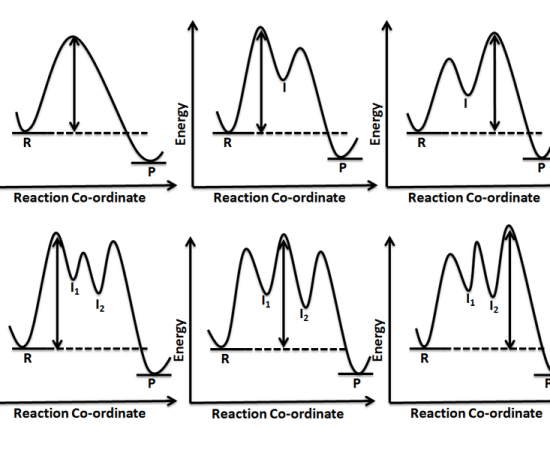 図2:遷移状態
図2:遷移状態
遷移状態は、再び反応物に戻るのではなく、生成物を形成するために進む確率が高い。
化学反応を成功させるためには、反応物分子が適切な方向で互いにコロイド化する必要があります。
遷移状態やポテンシャルエネルギーが最も高い中間体は、非常に不安定です。
そのため、長い時間存在することはない。
そのため、化学反応の遷移状態をとらえることは困難です。
活性化エネルギー
化学反応の活性化エネルギーとは、反応から生成物を得るために乗り越えなければならないエネルギー障壁のことです。
反応物が生成物に変化するために必要な最小のエネルギーである。
したがって、活性化エネルギーは、化学反応の遷移状態のポテンシャルエネルギーに等しい。
活性型錯体と遷移状態の関係
- 化学反応において中間分子が1つしかない場合、活性化錯体と遷移状態は同じです。
活性化複合体と遷移状態の違い
定義
活性化錯体。
活性化錯体とは、化学反応の進行中に形成される中間分子の集合体を指す。
遷移状態。
化学反応において、最も高いポテンシャルエネルギーを持つ中間体を指す。
ポテンシャルエネルギー
活性化錯体。
活性化錯体は反応物より高いポテンシャルエネルギーを持つ。
遷移状態。
遷移状態:他の中間構造の中で最もポテンシャルエネルギーが高い。
製品形態
活性化された錯体。
活性化錯体は反応の最終生成物を形成するか、または生成物を与えずに反応物を形成して逆行することができる。
遷移状態。
遷移状態は、再び反応物を形成するのではなく、生成物を形成する確率が高い。
結論
化学反応の中には、いくつかの段階を経て起こるものがあります。
反応物を含む初期段階、中間分子を含む遷移状態、生成物を含む最終段階の3段階に大別される。
このような化学反応について説明する用語として、活性化錯体と遷移状態があります。
活性化錯体と遷移状態の大きな違いは、活性化錯体がすべての可能な中間体を指すのに対し、遷移状態は最もポテンシャルエネルギーの高い中間体を指す点です。
