Main Difference – Endergonic vs Exergonic (主な違い)
エンドエルゴニックとエクセルゴニックという用語は、2種類の化学反応を説明するために使われます。
エンドエルゴニック反応とは、非自発的な反応のことです。
室温や大気圧のような通常の条件下では起こりません。
エクセルゴニック反応とは、エンドエルゴニック反応の反対です。
自発的な反応です。
外力がない通常の状態で起こる。
すべての化学反応は、エンド・エルゴニック反応とエクセルゴニック反応に分類されます。
エンドエルゴニック反応とエクセルゴニック反応の主な違いは、エンドエルゴニック反応が外からのエネルギーを必要とするのに対し、エクセルゴニック反応はエネルギーを外部に放出することである。
エンダゴニックとは
Endergonic とは、Gibbs 自由エネルギーが正の反応です。
ギブス自由エネルギーは、化学反応が自発的か非自発的かを予測するために用いられる熱力学的なポテンシャルです。
ギブス自由エネルギーが負であれば、自発的な反応であることを示します。
エンドエルゴニック反応の場合、ギブス自由エネルギーは正の値であり、これは非自発的反応であることを示す。
非自発的な反応は、不利な反応と名づけることもできる。
エンドゴーニック反応のギブス自由エネルギーは、次の熱力学的関係で計算すると正の値になります。
ΔG = ΔH – TΔS
ここで、ΔGはギブズ自由エネルギー
ΔH はエンタルピーの変化量
T は系の温度
ΔSは、エントロピーの変化量。
非自発的な反応では、反応を進行させるために外部からエネルギーを供給する必要がある。
このとき、生成物のエネルギーは、反応物のエネルギーよりも大きな値になる。
そのため、エンタルピーの変化は正の値になります(エンタルピーの変化は、生成物と反応物のエンタルピーの差です)。
新しい生成物ができるため、系のエントロピーは減少する。
すると、上式によれば、ΔGは正の値となる。
エンダゴニック反応には吸熱反応も含まれる。
エクセルゴニックとは
Exergonicとは、Gibbs自由エネルギーが負になる反応のことである。
これは、自発的な反応は、以下に示す熱力学的な関係で計算するとギブスエネルギーが負の値になるため、エクセルゴニック反応が自発的な反応であることを示します。
ΔG = ΔH – TΔS
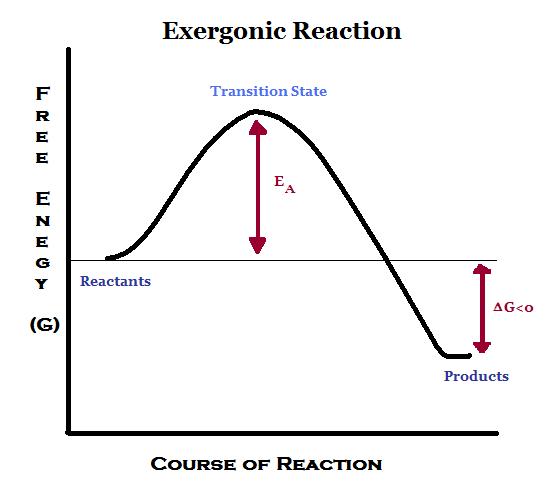 図1:エクセルゴニック反応のエネルギーダイアグラム
図1:エクセルゴニック反応のエネルギーダイアグラム
発熱性反応では、エネルギーが周囲に放出される。
そのため、生成物は反応物よりもエネルギーが低くなる。
そのため、エンタルピーの変化は負の値になります。
エントロピーは、系の無秩序化により増加する。
上記の関係から、ギブス自由エネルギーは負の値となる。
エクセルゴニック反応には発熱反応も含まれる。
エンダゴニックとエクセルゴニックの違い
定義
Endergonic。
Endergonicは、正のギブス自由エネルギーを持つ反応のタイプです。
Exergonic。
Exergonicは、負のGibbs自由エネルギーを持つ反応のタイプです。
ギブス自由エネルギー
エンダゴニック型。
エンドエルゴニック反応ではギブスの自由エネルギーは正の値です。
Exergonic。
脱力系の反応では、ギブスの自由エネルギーは負の値です。
反応物および生成物のエネルギー
Endergonic: 内向的な反応では,反応物のエネルギーは生成物のエネルギーより低い.
反応物のエネルギーが生成物のエネルギーより高い.
エントロピ
エンダゴニック。
内向的な反応ではエントロピーが減少する。
Exergonic。
脱力系の反応ではエントロピーが増加する。
自然
エンダゴニック反応。
非自発的な反応です。
Exergonic。
Exergonic反応は自発的です。
例
エンダゴニック。
吸熱反応とは、エンドエルゴニック反応です。
Exergonic(発熱性)。
発熱反応はexergonicな反応です。
反応の始まり
エンダゴニック反応 反応開始時に必ずエネルギーが必要な反応。
Exergonic。
反応開始時にエネルギーを必要としない反応。
エネルギー交換
エンダゴニック反応 エンダゴニック反応:周囲からエネルギーを吸収する反応。
Exergonic(発熱性)。
エネルギーを周囲に放出する反応。
結論
私たちの身の回りで起こるすべての化学反応は、エンドエルゴニック反応とエキサーゴニック反応のどちらかに分類することができます。
この2種類の反応は、定義も性質も正反対です。
エンドエルゴニック反応とエクセルゴニック反応の主な違いは、エンドエルゴニック反応が外部からエネルギーを必要とするのに対し、エクセルゴニック反応は外部へエネルギーを放出することである。
